Publié le 15 nov 2020Lecture 10 min
Apport de l’imagerie multimodale dans l’évaluation d’une insuffisance aortique
Augustin COISNE* et Théo PEZEL*, Lille et Paris
L’insuffisance aortique (IAO) est une valvulopathie peu fréquente, mais dont la prévalence augmente avec l’âge et qui touche préférentiellement les hommes d’âge moyen. Son évaluation est complexe et l’imagerie multimodale est primordiale pour préciser son mécanisme, quantifier sa sévérité, évaluer son retentissement et proposer une prise en charge adaptée.
Étiologie et physiopathologie
L’IAo touche 1 % de la population avant 50 ans, mais sa prévalence augmente avec l’âge, atteignant 5 % pour les personnes âgées de plus de 70 ans. Dans la moitié des cas, l’IAo est d’origine dégénérative, mais l’atteinte de la valve aortique peut être rhumatismale (15 %), congénitale (15 %) avec en chef de file la bicuspidie aortique, liée à une endocardite (8 %) ou inflammatoire (4 %) (figure 1)(1). L’IAo est caractérisée par une surcharge mixte de volume et de pression et sur le plan cellulaire par une augmentation en longueur des cardiomyocytes.
Figure 1. Étiologie de l’IAo. D’après Iung et al. Eur Heart J 2003 ; 24 : 1231-43.
Mécanismes
L’évaluation du mécanisme est indispensable pour pouvoir quantifier la sévérité de la fuite et surtout proposer une prise en charge optimale. Les différents mécanismes sont définis par la classification de Carpentier : brièvement, le type 1 correspond à un élargissement de la racine aortique avec des sigmoïdes normales, le type 2 à un prolapsus et le type 3 à une restriction des sigmoïdes (figure 2).
Figure 2. Mécanismes de l’IAo selon la classification de Carpentier. Le type 1 correspond à un élargissement de la racine aortique avec des sigmoïdes normales et un hiatus central (flèche jaune), le type 2 à un prolapsus de la sigmoïde antérodroite (flèche jaune) en ETO et le type 3 à une calcification et une restriction de la sigmoïde postérieure (flèche jaune) en ETT.
L’échocardiographie transthoracique (ETT) constitue la modalité de première intention pour préciser le mécanisme compte tenu de sa résolution temporo-spatiale, de son coût, de son absence d’irradiation et de sa disponibilité. L’échocardiographie transœsophagienne (ETO) peut être également proposée en cas de mauvaise échogénicité, de doute diagnostique ou lorsqu’une prise en charge thérapeutique spécifique est envisagée. Ainsi elle permet de préciser le nombre de cups (uni-, bi-, tri- ou quadricuspidie) (figure 3), la qualité des valves et le degré de calcification, une anomalie de l’aorte ascendante (une dilatation de l’aorte ou une coarctation associée). Le développement de la 3D permet par ailleurs une évaluation plus précise de la complexité de l’atteinte valvulaire.
Figure 3. Évaluation de nombre de sigmoïdes en ETT et en ETO. (A) Bicuspidie de type 1 L-R avec raphé fusionné entre la sigmoïde coronaire gauche et coronaire droite (flèche jaune). (B) Bicuspidie de type 2 avec 2 raphés (flèches jaunes). (C) Quadricuspidie aortique.
Le scanner et l’IRM cardiaques ne permettent pas en général d’identifier la présence d’un prolapsus ou d’une restriction de sigmoïde aortique du fait d’une résolution temporelle limitée par rapport à l’échocardiographie. Cependant, ces examens peuvent être très utiles, en cas de doute sur une bicuspidie aortique en échocardiographie. Ainsi, même si le scanner est l’examen de référence avec une sensibilité de 94 % et une spécificité de 100 % pour le diagnostic de bicuspidie aortique(2), n’hésitez pas à rechercher cette bicuspidie en IRM cardiaque sur les images ciné lorsqu’elle est réalisée pour évaluer la sévérité de l’IAo. Enfin, il est important de retenir que c’est uniquement sur les coupes en systole que l’on peut s’assurer avec certitude de l’absence de bicuspidie ou de raphé en pratique (figure 4).
Figure 4. Évaluation de nombre de sigmoïdes en IRM cardiaque. (Courtoisie images, Service de radiologie, CHU Lariboisière, Paris) Patient avec valve aortique
tricuspide aortique normale en diastole (A) et en systole (B). Notez que c’est toujours en systole (valve ouverte) que l’on s’assure de l’absence de bicuspidie et de raphé associé. Patient avec bicuspidie de type 1 L-R avec raphé fusionné entre la sigmoïde coronaire gauche et coronaire droite (flèche blanche), difficile à distinguer en diastole (C), mais bien visible en systole (D) avec une ouverture elliptique dite en « bouche de poisson » (contrairement à l’ouverture triangulaire d’une valve aortique tricuspide).
Enfin, bien que l’échocardiographie permette de rechercher une dilatation de l’aorte ascendante associée à l’IAo, angioscanner et angio-IRM aortiques présentent des performances supérieures pour la mesure de l’ensemble de l’aorte thoracique (ascendante, crosse aortique et descendante)(3). Ainsi, en cas de doute en échocardiographie, ou dans le bilan pré-interventionnel, si une intervention est envisagée, la réalisation d’un scanner cardiaque est recommandée (souvent préféré à l’IRM pour sa meilleure résolution spatiale).
Sévérité
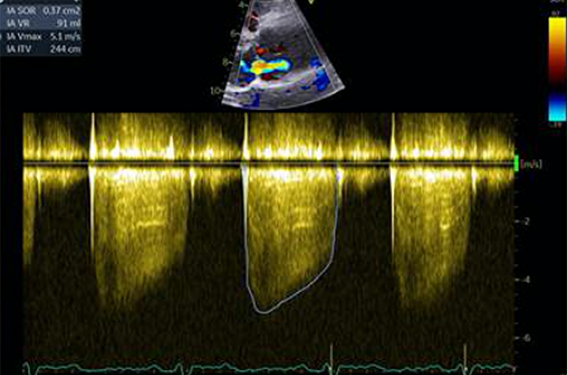
La quantification de la sévérité doit être réalisée systématiquement, cette dernière étant étroitement liée aux événements cardiovasculaires. Il existe différents paramètres qualitatifs, semi-quantitatifs ou quantitatifs en ETT(4). Concernant les paramètres qualitatifs et semi-quantitatifs, une insuffisance aortique sévère est évoquée en cas d’effet télédiastolique dans l’isthme aortique > 20 cm/s, de largeur de la vena contracta (VC) > 6 mm, ou de temps de demi-pression (pressure half time [PHT]) < 200 ms (figure 5). L’effet télédiastolique dans l’isthme aortique devra être mesuré au sommet de l’onde R, en Doppler pulsé, en aval du départ de l’artère sous-clavière gauche et la vitesse maximale de la PHT devra être > 4 m/s pour s’assurer d’un alignement correct. Il est important de noter que la mesure de la largeur de la VC est le paramètre semi-quantitatif le plus pertinent pour éliminer une fuite aortique sévère. Ainsi, une VC < 3 mm possède une valeur prédictive négative de 100 % ne nécessitant donc pas une quantification plus poussée (figure 6)(5).
Figure 5. Paramètres qualitatifs et semi-quantitatifs pour évaluer la sévérité de l’IAo. (A) Effet télédiastolique dans l’isthme aortique à mesurer au sommet de l’onde R, (B) après avoir positionné l’échantillon du Doppler pulsé dans l’aorte descendante, en aval du départ de l’artère sous-clavière gauche. Une IAo sévère est évoquée en cas d’EDTD > 20 cm/s, (C) d’une VC > 6 mm et (D) d’une PHT < 200 ms.
Concernant les paramètres quantitatifs, une IAo sévère est définie par une surface de l’orifice régurgitant (SOR) ≥ 30 mm2, un volume régurgitant (VR) ≥ 60 ml/batt et/ou à un élargissement des cavités cardiaques. Il conviendra d’obtenir ces paramètres par différentes techniques, que ce soit par la méthode de la zone de convergence (proximal isovelocity surface area [PISA]) ou par la différence de la différence des volumes éjectés. Le volume régurgité est alors défini par le volume éjecté en sous-aortique (qui passe par la valve aortique) moins le volume éjecté systémique (évalué sur la valve mitrale ou préférentiellement sur la valve pulmonaire) (figure 7). À noter que la méthode de la zone de convergence peut être difficile à réaliser ou non fiable pour de nombreuses raisons (jets multiples, orifice non circulaire ou non plan, jet excentré, absence de visualisation de la zone de convergence en raison de calcifications…).
Figure 7. Paramètres quantitatifs pour évaluer la sévérité de la fuite. A) Méthode de la différence des volumes éjectés et B) Méthode de la zone de convergence. Une IAo sévère est définie par une SOR ≥ 30 mm² ou un VR ≥ 60 ml/battement.
L’IAo est incontestablement une des valvulopathies dont la sévérité est la plus difficile à évaluer en échocardiographie, et devra toujours reposer sur une réflexion multiparamétrique. Ainsi, en cas de doute sur l’évaluation de sa sévérité en échocardiographie, et devant toute IAo au moins modérée, il est de bonne pratique d’avoir recours à l’IRM cardiaque avec séquence de flux permettant une mesure précise et assez reproductible du volume régurgitant et de la fraction de régurgitation de l’IAo(6). En routine, on retient que l’IAo est considérée comme sévère pour une fraction de régurgitation > 33 % en IRM cardiaque. En tant que clinicien, il est important de bien comprendre le principe de cette mesure réalisé en IRM, qui est détaillée dans la légende de la figure 8, afin de s’assurer de la robustesse des résultats. En effet, il est important de préciser que la fiabilité de ces mesures repose sur des conditions de mesure strictes et un respect des réglages de la séquence IRM. En effet, en cas de mauvais réglage de la vitesse d’encodage de la séquence (risque d’aliasing comme en échocardiographie) ou de mauvais positionnement des plans de coupes, il existe un risque d’obtenir une mesure erronée(6). Enfin, la quantification de l’IAo en IRM cardiaque peut être réalisée de façon fiable en cas de sténose aortique associée, ou dans l’évaluation d’une fuite post-TAVI, des questions fréquentes en pratique clinique(6).
Figure 8. Principe général de quantification d’une IAo en IRM cardiaque à partir des séquences de flux. (D’après Massimo Lombardi et al. The EACVI
Textbook of CMR 2019). Sélection des deux coupes de repérage utilisées pour positionner un plan de coupe (en rouge) placé perpendiculairement à la racine aortique et positionné au niveau de la jonction sino-tubulaire (A et B). L’acquisition d’une séquence de flux dans ce plan de coupe conduit au ciné de cartographie de flux visualisé à droite (C et D). Une cartographie de flux est toujours constituée d’une image anatomique dite « Module » permettant de repérer le plan de l’aorte (C), et d’une image de « Phase » correspondant à la vitesse du flux encodé perpendiculairement au plan de coupe. À noter sur la séquence de phase (D), un flux de couleur noir lorsqu’il descend vers les pieds (aorte descendante) et de couleur blanche lorsqu’il remonte vers la tête (aorte ascendante). Cela signifie que l’IAo apparaîtrait sur cette coupe sous la forme d’un hyposignal noir au niveau de l’aorte ascendante. Enfin, le logiciel est capable de nous fournir la courbe du flux aortique (E) mesuré dans la région d’intérêt (cercle rouge du ciné C et D). Sur cette courbe on distingue le flux aortique antérograde normal (flèche rouge) et le flux rétrograde correspondant à l’IAo (flèche jaune) permettant un calcul automatique du volume régurgitant et de la fraction de régurgitation de l’IAo.
Retentissement
L’évaluation du retentissement de la valvulopathie devra être faite également de manière systématique en s’attachant particulièrement au diamètre télédiastolique et diamètre télésystolique du ventricule gauche, ainsi qu’à la fraction d’éjection du ventricule gauche qui sont des éléments faisant partie des critères opératoires. L’évaluation devra se faire au mieux en 3D à défaut en 2D. Des marqueurs plus fins du retentissement myocardique semblent être intéressants pour stratifier le risque, notamment avec une valeur du strain longitudinal global en déformation myocardique > -18 à 19 % selon les études qui semble être associées à un mauvais pronostic, notamment en cas de prise en charge chirurgicale(7), et une activation neuro-hormonale avec des BNP ≥ 130 pg/ml. Il est à noter que ces marqueurs ne font pas partie des recommandations pour envisager une prise en charge chirurgicale. En cas de doute ou de difficulté sur la mesure des diamètres télédiastolique et télésystolique du ventricule gauche, l’IRM cardiaque pourra être utile permettant la mesure de ces mêmes diamètres sans limites d’échogénicité. De plus, une mesure des volumes télédiastolique et télésystolique du ventricule gauche viendra compléter la recherche d’une dilatation du ventricule gauche, bien que ces critères de volumes en IRM ne fassent pas partie officiellement des indications chirurgicales dans les recommandations. Rappelons que l’IRM cardiaque est l’examen de référence pour la mesure de ces volumes et de la FEVG.
Prise en charge
Une prise en charge chirurgicale est indiquée en cas de patient symptomatique (classe I, B), en cas de dysfonction ventriculaire gauche avec une FEVG ≤ 50 % chez un patient asymptomatique (classe I, B), chez un patient devant bénéficier d’un pontage aorto-coronaire, d’une chirurgie de l’aorte ascendante ou d’une autre valve (classe I, C) (figure 9)(8). Une chirurgie devra également être considérée chez un patient asymptomatique avec une FEVG > 50 %, mais avec un retentissement et une dilatation du ventricule gauche significative définie par un DTDVG > 70 mm ou un DTSVG > 50 mm (ou > 25 mm/m2 chez un patient de petite taille) (classe II a, B). Une évaluation fine de la faisabilité d’une réparation valvulaire plutôt qu’un remplacement doit être réalisée, discutée en Heart Team, et proposée (classe I, C). Ces réparations sont néanmoins réservées à l’heure actuelle aux centres experts, notamment pour les types 1 et 2 de la classification de Carpentier.
Figure 9. Recommandations sur la prise en charge de l’IAo. D’après Baumgartner H et al. Eur Heart J 2017 ; 38(36) : 2739-91.
En pratique
▸ L’insuffisance aortique est probablement l’une des valvulopathies les plus difficiles à évaluer en routine.
▸ L’évaluation de sa sévérité nécessite une expertise pluridisciplinaire incluant une équipe d’imagerie multimodale au sein de la "Heart Team" justifiant de référer tout patient avec une IAo potentiellement sévère à un centre médico-chirurgical de référence.
▸ L’approche en échocardiographie sera toujours multiparamétrique, et l’IRM cardiaque sera à proposer en cas de fuite au moins modérée en échocardiographie afin d’obtenir le maximum d’information avant de conclure de façon collégiale sur la sévérité de la fuite, son mécanisme, son retentissement afin d’envisager sa prise en charge.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :