Publié le 15 mai 2022Lecture 10 min
Incidence et diagnostic du thrombus intraventriculaire gauche
Audrey CAILLIAU1, Thirizi SI MOUSSI2, Jean-Guillaume DILLINGER3*
La découverte d’un thrombus intraventriculaire gauche (intra-VG) est souvent le reflet d’une cardiopathie sévère. Son incidence est relativement faible, mais suffisamment fréquente pour poser régulièrement des problèmes diagnostiques dans notre pratique quotidienne. L’objectif de cet article est de faire une mise au point sur l’incidence du thrombus intra-VG en fonction du type de cardiopathie et sur les différentes modalités d’imagerie permettant d’affirmer son diagnostic.
• Épidémiologie du thrombus intraventriculaire gauche
Le développement d’un thrombus intra-VG est une des complications de la dysfonction systolique du ventricule gauche. Si sa fréquence prédomine dans les cardiopathies ischémiques (CMI) notamment après un infarctus du myocarde (IDM), elle n’est pas rare dans les cardiopathies non ischémiques.
La prévalence globale du thrombus intra-VG dans la population générale (toutes cardiopathies confondues) est faible (moins de 1 ‰). Dans l’étude la plus récente ayant détaillé les cardiopathies sous-jacentes au développement d’un thrombus intra-VG(1) à partir de l’analyse des échographies cardiaques, la CMI est largement majoritaire (79 %). Les autres cardiopathies retrouvées sont la cardiopathie dilatée non ischémique (14 %), la myocardite (4 %), la cardiomyopathie hypertrophique (1,5 %) et la cardiomyopathie de Takotsubo (1,5 %).
Thrombus VG dans la cardiopathie ischémique
Les mécanismes physiologiques de la thrombose ont été décrits pour la première fois par Rudolf Virchow au XIXe siècle. Il soulignait la nécessité de trois facteurs pour le développement d’un thrombus : un facteur pariétal (lésion tissulaire), un facteur hémodynamique (stase sanguine) et un facteur sanguin (hypercoagulabilité). Si nous prenons l’exemple de l’IDM, l’inflammation secondaire à l’ischémie entraîne un état d’hypercoagulabilité et la nécrose myocardique entraîne une lésion pariétale. Un trouble de la cinétique avec akinésie ou dyskinésie du myocarde est à l’origine de la stase sanguine qui favorise la formation d’un thrombus. Nous retrouvons donc les trois facteurs qui concourent à la formation du thrombus.
Dans la littérature, le taux d’incidence du thrombus intra-VG est très variable dans la CMI. Cette variabilité est principalement expliquée par l’avènement des stratégies de revascularisation coronaire percutanée précoce dans les années 1990, qui a transformé le pronostic de l’IDM à la phase aiguë en réduisant de manière considérable les taux de mortalité, mais aussi les conséquences fonctionnelles et mécaniques telles que la dysfonction VG et donc le thrombus intra-VG.
Globalement, les études réalisées avant 1990, c’est-à-dire avant la généralisation des stratégies de reperfusion précoce de l’IDM, ont montré une incidence du thrombus intra-VG qui varie entre 14 % et 25 %, pouvant aller jusqu’à 40 % dans les séries de patients avec un IDM antérieur.
Après 1990, les études sur l’infarctus du myocarde rapportent une incidence plus faible du thrombus intra-VG qui varie selon la méthode diagnostique utilisée pour le dépistage : entre 1,6 et 4 % pour les études basées sur l’échocardiographie et entre 6 et 9 % pour les études basées sur l’IRM cardiaque.
Il faut noter que la détection d’un thrombus intra-VG est très variable, selon la modalité d’imagerie choisie, le moment de réalisation de l’examen d’imagerie et la fréquence du dépistage. Ainsi, un thrombus peut rester sous-diagnostiqué si une recherche méticuleuse n’est pas entreprise, en particulier dans les jours à semaines suivant l’IDM. Retarder l’imagerie de 5 jours après un IDM semble associé à une augmentation du taux de détection d’un thrombus intra-VG, atteignant un maximum de détection entre 9 et 12 jours après l’IDM(2).
Thrombus VG dans la cardiopathie non ischémique
La plupart des séries rapportées de thrombi intra-VG s’intéressent à la cardiopathie ischémique, et il y a peu d’études chez les patients avec des étiologies non ischémiques. De plus, il s’agit la plupart du temps d’échantillons de petits effectifs, ce qui entraîne une faible précision avec des intervalles de confiance larges pour déterminer l’incidence précise du thrombus intra-VG dans ces cardiopathies.
Comme mentionné précédemment, lors de la découverte d’un thrombus, la cardiopathie sous-jacente est une cardiopathie dilatée non ischémique dans 14 % des cas, ce qui n’est pas négligeable. La cardiopathie dilatée dite « à coronaires saines » regroupant elle-même de nombreuses étiologies : la cardiopathie du post-partum, les cardiopathies toxiques (post-ch miothérapie, œnolique...), les cardiopathies rythmiques, les cardiomyopathies primitives héréditaires, la maladie de Chagas, etc.
Dans une cohorte de 121 patients présentant une dysfonction ventriculaire gauche < 30 % post-chimiothérapie, Kitkungvan et coll. rapportent une prévalence du thrombus intra-VG de 7,4 %. Ce taux relativement élevé peut s’expliquer chez ces patients présentant une tumeur maligne active par un état d’hypercoagulabilité et d’inflammation chronique qui augmente le risque thrombo-embolique.
Concernant la maladie de Chagas, pourvoyeuse de cardiopathies dilatées, principalement en Amérique du Sud, une étude sur une cohorte de 330 patients parmi lesquels 39 % avaient un anévrisme apical et une FEVG moyenne à 39 ± 14 % montrent une prévalence du thrombus intra-VG de 15 %.
Il existe peu d’études chez les patients atteints de cardiomyopathie de stress (Takotsubo). L’incidence rapportée du thrombus intra-VG dans cette population de patients est de 3 à 5 %. La plus grande cohorte de patients (n = 1 676) atteints de cette maladie a enregistré une prévalence de 3,3 % de thrombus intra-VG identifié et/ou embolie(3). Les patients atteints d’un syndrome de Takotsubo présentent généralement une ballonisation apicale akinétique du ventricule gauche, mais l’incidence plus faible du thrombus intra-VG s’explique par sa nature transitoire et à l’absence de dommages endocardiques par rapport à l’IDM. Dans la cohorte de l’« International Takotsubo Registry », les patients avec un thrombus intra-VG et/ou une embolie avaient une FEVG plus altérée < 30 %, majoritairement une forme avec atteinte de l’apex, et un taux plus élevé de troponine et de marqueurs inflammatoires. Une étude américaine a récemment étudié rétrospectivement le taux de thrombus intra-VG compliquant la cardiopathie du péripartum aux États-Unis. Sur 43 986 patientes, 452 avaient un thrombus intra-VG soit 0,01 %. Certaines études ont retrouvé que l’incidence du thrombus intra-VG dans la cardiopathie du péripartum était plus élevée chez les sujets afro-caribéens. Enfin, dans la cardiomyopathie hypertrophique (CMH), les données sont relativement peu nombreuses. Dans une série de 5 cas de patients avec thrombus intra-VG, tous avaient un anévrisme apical associé, ce qui est rarement constaté dans les CMH. Dans une série de 2017 sur 1 940 patients, 4,8 % avaient un anévrisme apical et 19 % d’entre eux un thrombus intra-VG (soit 0,9 % de la série totale). Dans la cardiopathie amyloïde, il a été décrit de manière sporadique, la présence d’un thrombus intra-VG, ce qui reste relativement exceptionnel.
Facteurs associés au développement d’un thrombus intra-VG dans la cardiopathie ischémique
Plusieurs facteurs ont été identifiés comme facteurs de risque de développement d’un thrombus intra-VG et sont communs à toutes les études sur les cardiopathies ischémiques (tableau 1). Parmi les principaux facteurs retrouvés, on note un IDM du territoire antérieur, un IDM vu tardivement, la présence d’une dysfonction VG, l’existence d’un anévrisme du VG, une revascularisation coronaire incomplète, un SYNTAX score élevé, une élévation des D-dimères. Les patients ayant présenté un syndrome coronarien aigu avec sus-décalage du ST sont plus susceptibles de présenter un thrombus intra-VG que les patients avec un syndrome coronarien aigu sans sus-décalage du ST (35 % vs 11 %).
• Modalités d’imagerie pour le diagnostic du thrombus intra-VG
Échographie cardiaque
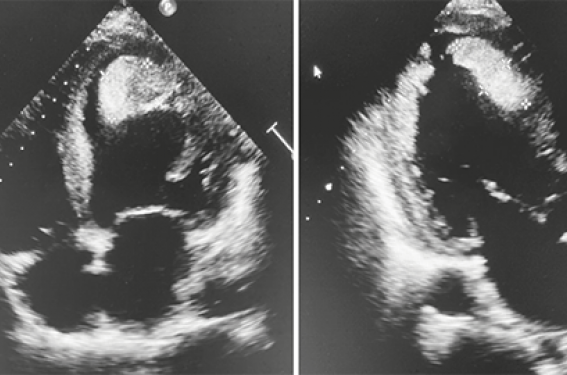
L’échographie cardiaque transthoracique (ETT) est l’examen clé pour dépister le thrombus intra-VG, soit dans les suites d’un syndrome coronarien aigu ou lors du bilan étiologique d’un accident vasculaire embolique. Le diagnostic de thrombus intra-VG repose sur la présence d’une masse de taille variable, sessile ou pédiculée, de contours bien définis et distincts de l’endocarde, contiguë d’un segment myocardique akinétique ou dyskinétique, d’échogénicité supérieure à celle du sang et présente pendant toute la durée du cycle cardiaque sur au moins deux plans de coupes différents(4). La majorité de ces thrombi se situent au niveau de l’apex du ventricule gauche et les coupes apicales (4 cavités, 3 cavités, 2 cavités) sont les plus utiles et requièrent un soin particulier afin de multiplier les incidences visualisant l’apex dans tous les axes (figures 1 et 2). Il est recommandé d’utiliser une sonde à haute fréquence 5 MHz, voire 7 MHz pour améliorer la qualité de l’image. L’échographie cardiaque sans contraste est un examen peu coûteux, disponible rapidement et notamment au lit du patient, mais qui reste opérateur-dépendant. L’ETT a démontré une bonne spécificité de 82 %, mais une sensibilité faible à 23 %. En revanche, lors d’une probabilité forte ou d’un diagnostic douteux, il faut avoir recours à une évaluation multi-modale et différentes options peuvent être utilisées.
Présence de contraste spontané
La présence de contraste spontané est associée à un haut risque de formation de thrombus intra-VG. Une étude rétrospective publiée en 2021, comprenant 417 patients avec un contraste spontané à l’échographie, a montré un taux d’incidence d’événement thrombo-embolique (AVC, ischémie périphérique) de 12,9 % sur 1 an, indépendamment de tout autre facteur favorisant. Les facteurs de risque identifiés étaient : l’âge, l’ACFA, l’hémoglobine, la présence ou non de traitement anticoagulant et la FEVG. Concernant le suivi de ces patients, le taux de D-dimères et une FEVG altérée étaient les facteurs de risque de persistance de contraste spontané. Ces éléments pourraient être pris en compte dans le traitement préventif du thrombus intra-VG .
Échographie cardiaque de contraste
En cas d’échogénicité suboptimale ou de doute diagnostique, l’usage d’agent de contraste intraveineux est intéressant, car il permet d’opacifier la cavité du ventricule gauche et notamment l’endocarde, et ainsi différencier les structures normales (trabéculations, faux tendons...) des structures anormales du cœur (thrombus). Aujourd’hui, tous les échographes disposent de module d’imagerie de contraste, ce qui permet l’obtention d’images d’excellente qua- lité. De nombreux agents sont commercialisés, leur utilisation est sûre. L’effet indésirable principal est la réaction d’allergie et notamment le choc anaphylactique dans une proportion très rare 0,01 %.
Agent de contraste à la phase aiguë d’infarctus ?
Il existe une controverse sur l’utilisation de ces agents de contraste chez les patients instables. En effet, en 2007, la FDA a rapporté 4 décès spontanés et 190 complications « cardio-pulmonaires graves » ; ceci a fait momentanément suspendre leur utilisation chez les patients instables, avec une insuffisance cardiaque sévère ou à la phase aiguë d’infarctus (chez les patients qui en bénéficient le plus en général). Rapidement, de nombreuses études très rassurantes ont été publiées sur le faible risque de complication et une analyse des dossiers des patients a permis de conclure que les complications graves rapportées étaient liées à la gravité de la pathologie des patients et non à l’utilisation d’agent de contraste. En 2008, la FDA a levé la contre-indication chez les patients avec une insuffisance cardiaque sévère, des troubles du rythme graves ou un infarctus aigu du myocarde. Cette contre-indication a été remplacée par une précaution d’emploi avec une surveillance de 30 min post-injection, afin de s’assurer de l’absence de complication allergique(5). Avec une sensibilité 61 % et une spécificité 92 %, l’échographie de contraste doit être utilisée en cas de doute diagnostique notamment en post-infarctus et en l’absence d’autre technique d’imagerie disponible rapidement.
Imagerie par résonance magnétique myocardique
L’imagerie par résonance magnétique (IRM) cardiaque constitue le gold standard pour le diagnostic des thrombi intraVG, avec une sensibilité de 88 % et une spécificité de 99 %. Pour rechercher un thrombus intra VG, il est essentiel de réaliser des séquences cinés (2, 3 et 4 cavités), la localisation préférentiellement apicale des thrombi doit nous faire réaliser des plans de coupes dégageant l’apex (figure 3). Les séquences de rehaussements tardifs, réalisées dix minutes après injection de gadolinium, sont indispensables et améliorent la sensibilité des séquences ciné. En effet, les séquences cinés seules peuvent sous-détecter des thrombi apicaux, de petites tailles. Le thrombus intra-VG apparaît comme une masse avasculaire, en hyposignal (noir) sur les séquences de perfusions et de rehaussement tardif. Dans le cas de la cardiopathie ischémique, il faut distinguer le thrombus intra-VG (qui apparaît comme une masse homogène en hypo-signal dans la cavité VG, distincte de l’endocarde) de l’obstruction microvasculaire (qui apparaît aussi en hyposignal, mais englobée au sein de l’hypersignal de la zone infarcie, souvent hétérogène et « patchy »). Dans les cas litigieux, l’utilisation d’un temps d’inversion plus long autour de 600-700 ms permet d’optimiser le contraste entre le thrombus et le myocarde, ainsi le thrombus apparaîtra davantage en hypo-signal (noir). En cas de risque élevé de formation de thrombus intra-VG, l’examen d’imagerie ne doit pas être réalisé trop précocement et éventuellement répété. Malgré sa précision diagnostique, l’IRM cardiaque reste un examen onéreux et dont la disponibilité est variable en fonction des centres hospitaliers. À partir d’une métaanalyse publiée par Bulluck et coll. en 2018, nous proposons un algorithme afin d’améliorer la recherche de thrombus intra-VG dans le syndrome coronarien aigu (figure 4).
Scanner cardiaque
Le recours au scanner cardiaque en tant qu’imagerie diagnostique structurelle cardiovasculaire s’est développé au cours des dernières années. Cette imagerie présente des avantages grâce à ses capacités de caractérisation et discrimination des tissus par évaluation de la densité et la diffusion(6). Contrairement à l’ETT, la qualité de l’image est indépendante du poids ou de la morphologie du patient ou par exemple de l’existence d’une maladie pulmonaire qui peuvent considérablement limiter la fenêtre acoustique et donc la qualité de l’image en ETT. De plus, les progrès des dernières décennies ont permis d’obtenir une meilleure résolution spatio-temporelle, des capacités de reconstruction multiplanaire précise fournissant une évaluation détaillée des thrombi intracardiaques et des structures adjacentes. L’ajout de la synchronisation de l’acquisition des images à l’ECG a permis de réduire considérablement les artéfacts liés aux mouvements cardiaques. Au scanner, le thrombus apparaît sous la forme d’une image hypodense non rehaussée, en général arciforme, au contact d’une paroi ventriculaire. Il est nécessaire de réaliser une phase d’acquisition tardive, 5 minutes après injection afin de visualiser le thrombus (figure 5). Le scanner spectral sera probablement un outil supplémentaire dans le futur. Le tableau 2 présente les avantages et les inconvénients des différentes techniques d’imagerie pour le diagnostic de thrombus intra-VG.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


