Études-Consensus-Recommandations
Publié le 20 juin 2023Lecture 5 min
MINOCA : quelle stratégie diagnostique et thérapeutique ?
Nicolas COMBARET, service de cardiologie, CHU de Clermont-Ferrand
Le tableau de MINOCA (Myocardial Infarction With Non-Obstructive Coronary Artery disease) représente environ 6 % des infarctus du myocarde(1). Les causes sont multiples (dissection coronaire spontanée, spasme coronaire, complications de plaque athéro- mateuse...) et le diagnostic étiologique n’est pas simple. Le pronostic à long terme de cette pathologie semble meilleur que lors d’un infarctus « classique » avec obstruction coronaire, mais le taux de mortalité annuel reste estimé à 2 %(2). Il est donc primordial de ne pas méconnaître cette entité et d’avoir une démarche diagnostique rigoureuse pour adapter au mieux la prise en charge.
Les recommandations euro-péennes(3,4) et américaines(5) sur la démarche diagnostique à adopter en cas de MINOCA ont la même finalité : écarter un diagnostic différentiel, écarter une souffrance myocardique non ischémique (myocardite et syndrome de Takotsubo) et enfin confirmer le diagnostic de MINOCA et déterminer le mécanisme lésionnel.
La démarche diagnostique peut s’établir en 4 étapes.
Écarter un diagnostic différentiel
La première étape consiste à écarter toute pathologie qui peut entraîner une élévation enzymatique sans lésion myocardique : embolie pulmonaire, syndromes coronariens aigus de type 2 par anémie, sepsis, etc. Les examens complémentaires seront principalement biologiques (NFS, CRP) et l’angioscanner thoracique garde toute sa place pour éliminer une maladie thrombo-embolique ou un syndrome aortique aigu.
S’assurer qu’il ne s’agit pas d’un véritable infarctus du myocarde avec obstruction coronaire
Avant d’affirmer le diagnostic de MINOCA, une relecture fine et attentive des examens coronarographiques est primordiale afin de ne pas méconnaître des lésions obstructives parfois difficiles à reconnaître sur l’angiographie coronaire et qui touchent fréquemment des artères de petit calibre. L’opérateur s’attardera à rechercher, selon le contexte clinique :
– une obstruction coronaire athéromateuse distale sur des artères de petit calibre ou sur une branche de division ;
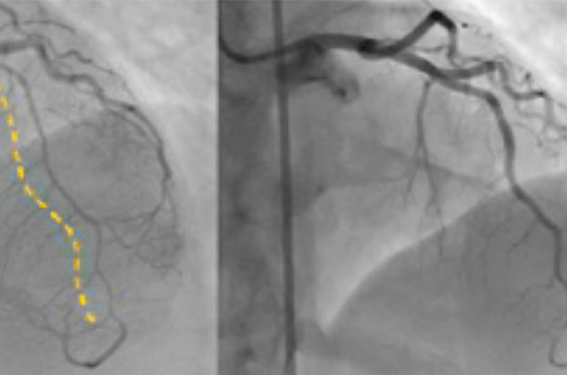
– une dissection coronaire spontanée (Spontaneous Coronary Artery Dissection SCAD) qui se présente majoritairement sous la forme d’hématome coronaire spontané sans flap et qui touche fréquemment des segments distaux ou des branches de division de petit calibre. Des signes angiographiques de SCAD ont ainsi été décrits(6) (figure 1) ;
– un embole coronaire avec un aspect souvent sain du réseau coronaire et une occlusion nette d’une artère distale souvent au niveau d’une bifurcation (embole enclavé au sein de la bifurcation).
Figure 1. Patiente de 49 ans admise pour SCA non-ST+ antérieur avec élévation de la troponine. L’angiographie initiale retrouve un aspect de compression extrinsèque de l’IVA depuis la première septale jusqu’à l’apex. Cette image peut être interprétée comme de l’athérome diffus ou elle est caractéristique d’une SCAD de type 2 de la classification de Saw. Sur le contrôle angiographique à 3 mois, on note une régression totale de l’hématome.
Écarter une souffrance myocardique d’origine non ischémique : myocardite et syndrome de Takotsubo
La myocardite et le syndrome de Takotsubo (cardiopathie de stress) ont longtemps été considérés comme des causes de MINOCA. Ce n’est plus le cas dans les dernières recommandations(4). Ces deux pathologies doivent donc être écartées avant de conclure à un vrai MINOCA. L’imagerie par résonance magnétique (IRM) joue à ce stade un rôle primordial. En cas de myocardite, l’IRM permet la détection d’un œdème myocardique (séquence T2 ou T2 mapping) et d’une nécrose myocytaire ou d’une fibrose cicatricielle (séquences de rehaussement tardif, de T1 mapping ou de volume extra-cellulaire) (figure 2).
Figure 2. Aspect caractéristique en IRM d’une myocardite virale : hypersignal en séquence T2 STIR de la paroi latérale témoignant d’un œdème de la paroi. Sur les séquences de rehaussement tardif (10 minutes après l’injection de gadolinium), on retrouve un hypersignal sous épicardique dans le même territoire témoignant des lésions tissulaires (Courtesy Dr Ballout).
Dans le cas d’un syndrome de Takotsubo, si le diagnostic n’a pas été fait à l’échographie transthoracique ou lors de la ventriculographie (image typique de ballonisation apicale avec hyper-contractilité de la couronne basale ne correspondant pas à un territoire coronaire), l’IRM retrouve ces mêmes troubles de cinétique et confirme l’absence de lésions myocardiques (pas d’anomalie de perfusion précoce ni de rehaussement tardif).
Déterminer l’étiologie du MINOCA
Ce n’est qu’à cette étape que le diagnostic étiologique du MINOCA est réellement fait. Les examens complémentaires s’attacheront à différencier deux causes possibles de MINOCA :
• MINOCA avec anomalie obstructive des artères coronaires : bien évidemment, il s’agit d’anomalies obstructives non visibles en angiographie. Il sera donc nécessaire d’avoir recours à de l’imagerie endocoronaire : IVUS (Intravascular Ultra Sound) ou OCT (Optical Coherence Tomography). Ces examens seront préférentiellement réalisés lorsque le clinicien suspecte un territoire coronarien donné (modifications ECG localisées, troubles de cinétique segmentaire, mise en évidence d’une nécrose myocardique focale en IRM). Les causes recherchées sont généralement des complications aiguës de plaque athéromateuse : rupture ou érosion de plaque avec présence de thrombus (figure 3).
Figure 3. Patient de 47 ans, tabagique admis pour SCA non-ST+ antérieur avec élévation de la troponine. L’imagerie angiographique initiale n’étant pas contributive, une imagerie OFDI est réalisée et retrouve au sein de l’IVA proximale une petite charge thrombotique sans lésion sténosante. Décision de poursuite d’un traitement médical seul sans stenting. Lors du contrôle OFDI à 3 mois, disparition complète du thrombus avec aspect évocateur d’érosion de plaque athéromateuse.
La charge thrombotique est variable : elle est souvent importante lorsque l’imagerie endocoronaire est réalisée en urgence, mais absente lorsque le contrôle est réalisé à distance (contrôle programmé au décours d’une IRM myocardique pathologique par exemple).
Enfin, du fait d’un diagnostic angiographique parfois difficile, l’imagerie endocoronaire peut permettre de confirmer le diagnostic de dissection coronaire spontanée. Cela est particulièrement vrai dans les cas de SCAD de type 2 (selon la classification de Saw[7]) qui correspondent à un hématome pariétal sans rupture intimale et qui s’apparentent à une simple réduction lisse du calibre en angiographie.
• MINOCA sans anomalie obstructive des artères coronaires : il s’agit de la situation où le clinicien n’a aucune orientation localisatrice du MINOCA (absence de modification ECG, pas de trouble de cinétique segmentaire, pas d’anomalies IRM). Dans ce contexte, la recherche d’un spasme coronaire ainsi que l’analyse de la microcirculation coronaire sont recommandées.
Les tests de provocation du spasme se feront préférentiellement grâce à l’injection intracoronaire d’acétylcholine ou d’ergonovine (plus utilisée en France et pourtant moins sensible). Leurs cibles d’action sont différentes puisque l’acétylcholine interagit avec les récepteurs muscariniques et sérotoninergiques de l’endothélium coronaire alors que l’ergonovine cible les récepteurs sérotoninergiques des cellules musculaires lisses(8).
L’analyse de la microcirculation pourra également être proposée même si les anomalies de la microcirculation sont plus généralement responsables de syndromes coronariens chroniques (INOCA pour Ischemia with Non-Obstructive Coronary Artery Disease). Elle se fera au cours d’un nouvel examen coronaro-raphique avec du matériel dédié (guides coronaires de pression) pour étudier principalement deux paramètres : une augmentation de l’indice de résistance microcirculatoire IMR (Index of Microcirculatory Resistance) et la diminution de la réserve coronaire CFR (Coronary Flow Reserve).
La stratégie diagnostique globale en cas de suspicion de MINOCA est résumée dans la figure 4.
Figure 4. Proposition d’algorithme décisionnel dans le cadre du bilan étiologique de MINOCA.
L’auteur n’a pas de conflit d’intérêts à déclarer en lien avec l’article.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :







