Rythmologie et rythmo interventionnelle
Publié le 06 oct 2009Lecture 7 min
Découverte d'un aspect de Brugada : que faire ?
M. LERECOUVREUX, J.-Y. LE HEUZEY, Hôpital Georges Pompidou, Paris
Depuis son introduction comme entité clinique en 1921, le syndrome de Brugada a suscité un intérêt croissant illustré par de très nombreuses publications. Sa pathogénie, ses facteurs pronostiques et son traitement restent sujets à controverses, ce qui peut susciter la perplexité du clinicien face à la découverte d’un cas. Après avoir fait l’état des lieux des connaissances sur ce syndrome, nous envisagerons les situations consensuelles mais aussi celles qui le sont moins.
Historique
Bien que l’aspect ECG de BBD avec sus-décalage du segment ST ait déjà été décrit, c’est aux frères Brugada que revient le mérite d’avoir fait le lien avec la survenue de morts subites, à partir d’une petite série(1). En 1997, ce syndrome a été rapproché du syndrome de mort subite inexpliquée endémique en Asie du Sud-Est(2). Le caractère héréditaire et le mode de transmission autosomique dominant ont été décrits dès 1996(3) puis des mutations du gène SCN5A, codant pour la sous-unité · du canal sodique cardiaque, ont été incriminées(4).
Bases biologiques
Le syndrome de Brugada fait partie des canalopathies touchant le canal sodique. Ce peut être une maladie sporadique ou familiale de transmission autosomique dominante. Plus de cent mutations responsables de syndrome de Brugada ont été décrites et étudiées par patch-clamp. Elles sont retrouvées dans 18 à 30 % des syndromes de Brugada et plutôt dans les cas familiaux(5). Les mutations les plus fréquemment rencontrées touchent la sous-unité · du canal sodique, codée par le gène SCN5A (locus 3q21-23)(6) et entraînent une réduction du courant sodique INa.
Sur le chromosome 3, un second locus lié au syndrome de Brugada mais différent de SCN5A a été récemment rattaché à une mutation du gène de la glycérol-3-phosphate déhydrogénase 1-like (GPD1L) responsable d’un défaut d’acheminement des canaux à la surface cellulaire et donc d’une réduction de INa(7).
La diminution du courant INa (phase 0 du potentiel d’action) est responsable d’une augmentation du courant potassique transitoire sortant Ito qui vient majorer l’encoche du potentiel d’action lors de la phase 1. Ce phénomène se produit préférentiellement dans l’épicarde du ventricule droit. Il se produit donc un gradient transmural de voltage responsable de l’onde J (mimant un bloc de branche droit) et du sus-décalage de ST dans les dérivations précordiales droites (figure 1 B et C). Le substrat arythmogène apparaît à la faveur d’un déséquilibre plus important des courants entrant et sortant aboutissant à la disparition du dôme du potentiel d’action dans certaines régions épicardiques (figure 1 D). Il se crée alors une dispersion épicardique et transmurale de repolarisation responsable d’une fenêtre vulnérable durant laquelle une extrasystole peut déclencher une tachycardie réentrante. La conduction d’un dôme de potentiel d’action d’une région où il est maintenu vers une région où il est aboli peut causer une réexcitation locale (réentrée de phase 2), conduisant au développement d’une extrasystole à couplage court en fenêtre vulnérable (figure 1 E) comme cela a été montré sur un modèle de cœur de chien perfusé(8).
Figure 1. Représentation schématique des modifications des potentiels d’action ventriculaires droits responsables des manifestations ECG du syndrome de Brugada (Antzelevitch8).
Caractéristiques cliniques
Définition
Les critères diagnostiques du syndrome de Brugada, précisés par le consensus d’expert du Groupe d’étude des bases moléculaires des arythmies de la Société Européenne de Cardiologie en 2002(9) puis par le consensus d’experts de l’European Heart Rhythm Association (EHRA) en 2005(10), associent des critères électrocardiographiques et cliniques. Trois types électrocardiographiques sont reconnus selon l’aspect des complexes QRST (figure 2) :
- type 1 : amplitude du point J ≥ 2 mm (0,2 mV), onde T négative et ST-T en forme de dôme,
- type 2 : amplitude du point J ≥ 2 mm (0,2 mV), onde T positive ou biphasique, segment ST-T en forme de selle avec portion terminale de ST surélevée d’au moins 1 mm,
- type 3 : amplitude du point J ≥ 2 mm (0,2 mV), onde T positive, segment ST-T en forme de selle avec portion terminale de ST surélevée de moins d’1 mm.
Figure 2. Classification des ECG de syndrome de Brugada9.
L’aspect typique (type 1) est fluctuant dans le temps et peut être démasqué par les bloqueurs des canaux sodiques, les états fébriles ou les agents vagotoniques(11,12). Le diagnostic de syndrome de Brugada est posé en présence d’un aspect ECG type 1 dans au moins deux dérivations précordiales droites (V1, V2 et V3), spontané ou démasqué par un agent bloqueur des canaux sodiques, associé à l’un des éléments suivants :
- une fibrillation ventriculaire (FV) documentée,
- une tachycardie ventriculaire (TV) polymorphe,
- un antécédent familial de mort subite avant l’âge de 45 ans,
- un aspect ECG type 1 chez un membre de la famille,
- l’inductibilité d’une TV lors de la stimulation ventriculaire programmée (SVP),
- une syncope,
- une respiration agonique nocturne.
Prévalence
Selon les populations étudiées, la prévalence du syndrome de Brugada se situe entre 0,03 % à 0,1 % (France)(13,14) et 0,12 % (Japon)(15) avec une nette prédominance masculine qui pourrait être expliquée par un courant Ito plus important dans l’épicarde ventriculaire droit des hommes(16). La prévalence élevée rencontrée en Asie pourrait être liée à un polymorphisme du promoteur de SCN5A fréquent dans cette région du monde(17).
Présentation clinique
Les patients symptomatiques présentent des épisodes de TV polymorphe ou de FV responsables de morts subites lorsque cette arythmie perdure. Lorsque l’arythmie s’arrête spontanément les patients présentent des syncopes, des convulsions ou encore des épisodes de respiration agonique nocturne avec agitation et perte d’urine, l’arythmie ventriculaire survenant volontiers pendant le sommeil. Le diagnostic erroné de syncope vasovagale est parfois posé car l’ECG peut être transitoirement normal et les patients ont souvent un test d’inclinaison positif.
Les patients asymptomatiques sont diagnostiqués à l’occasion d’un ECG de routine, lors d’un dépistage familial autour d’un cas ou, plus rarement, lorsque l’aspect ECG caractéristique est démasqué par un agent bloqueur des canaux sodiques administré pour une autre arythmie(18).
Il existe des facteurs favorisant les manifestations ECG et arythmiques du syndrome de Brugada : outre les agents bloqueurs des canaux sodiques et les états fébriles, les agents vagotoniques, les agonistes a-adrénergiques, les b-bloquants, les antidépresseurs tricycliques et tétracycliques, les antihistaminiques de première génération, la combinaison de glucose et d’insuline, l’hyperkaliémie, l’hypokaliémie, l’hypercalcémie, l’alcool et la cocaïne(8).
Stratification du risque
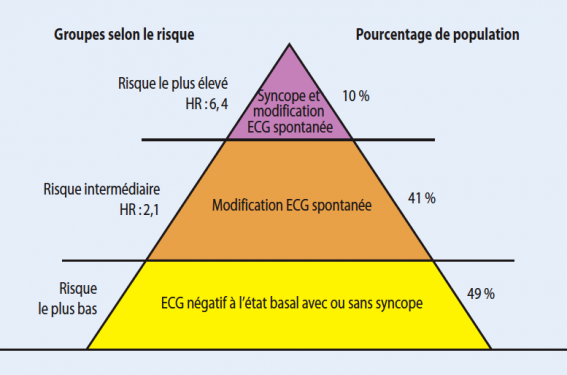
Il est généralement accepté que les survivants d’une mort subite récupérée sont à très haut risque de récidive. Les patients présentant des syncopes sont également reconnus comme étant à haut risque, particulièrement ceux avec ECG spontané de type 1 selon S. Priori (figure 3)(19) ou ceux dont la SVP est positive selon les frères Brugada(20).
Figure 3. Stratification du risque chez les patients porteurs de syndrome de Brugada sans antécédent de mort subite selon S. Priori19.
La question du pronostic des patients asymptomatiques reste très débattue. Dans le registre Brugada, le taux annuel d’évènements graves (mort subite, FV) chez les patients asymptomatiques était établi à 10 % en 1998(21), puis 3,5 %(22) en 2002 et 1,7 % en 2005(23). Priori et coll. retrouvent un taux annuel à 0,35 % en 2002(19) puis 1 % en 2005(24). Enfin Eckardt et coll. trouvent dans leur registre un taux plus bas à 0,24 % en 2005(25). La valeur pronostique de la SVP, considérée comme fondamentale par les frères Brugada, est remise en question par les registres « Priori » et « Eckardt ». Une récente méta-analyse comparant plus de 400 patients du registre « Brugada » à plus de 700 patients inclus dans 15 autres études retrouve cette divergence sur la valeur pronostique de la SVP sans en trouver d’explication(26). Les données du registre français Cobra sont également en faveur de l’absence d’intérêt pronostique de la SVP(27). Enfin, d’autres paramètres non invasifs (largeur de l’onde S, présence de potentiels tardifs ventriculaires, étude de la partie terminale de l’onde T) pourraient être utiles dans l’évaluation du risque(8).
En conclusion
Le défibrillateur automatique implantable (DAI) est la seule thérapie efficace prouvée. L’EHRA propose l’implantation d’un DAI chez les patients porteurs d’un ECG de type 1 (spontanément ou après blocage des canaux sodiques) ayant présenté une mort subite récupérée (indication de classe I). Les mêmes patients n’ayant présenté qu’une syncope, des convulsions ou une respiration agonique nocturne doivent recevoir un DAI après avoir éliminé une cause non cardiaque à ces symptômes (indication de classe I). Il faudra toutefois garder en mémoire la faible spécificité du test d’inclinaison dans l’enquête étiologique d’une syncope chez un patient porteur d’un syndrome de Brugada. L’exploration électrophysiologique n’est utile chez ces patients que pour l’évaluation des troubles du rythme supraventriculaires selon l’EHRA. Un DAI peut être proposé chez les patients asymptomatiques ayant un antécédent familial de mort subite dû à un syndrome de Brugada et une SVP positive (indication de classe IIa en cas d’ECG spontané de type 1 ou classe IIb en cas d’ECG de type 1 obtenu après blocage des canaux sodiques)(10). Ceci nous semble plus discutable à la lumière des données de la littérature sur la SVP, qui doivent être confrontées à la morbidité non négligeable associée à la pose d’un DAI. Ces incertitudes doivent être expliquées aux patients. Une approche pharmacologique visant au blocage du courant Ito par la quinidine a montré des résultats encourageants et peut être proposée, éventuellement guidée par la SVP(28). Il faut de plus impérativement traiter chez ces patients tout épisode fébrile, éviter les médicaments arythmogènes dans ce contexte et instaurer un suivi ambulatoire. Tous les aspects fréquemment rencontrés de type 2 ou 3 ne justifient un test de blocage des canaux sodiques que pour prodiguer les mêmes conseils en cas de conversion en type 1. Par ailleurs, les types 2 ou 3 avec test négatif ne sont pas des Brugada et ne nécessitent aucune précaution particulière.
Enfin, l’isoprotérénol et des inhibiteurs des phosphodiestérases ont montré un intérêt en cas d’orage rythmique en augmentant le courant calcique ce qui rétablit le dôme de potentiel d’action(29).
En pratique
Si la conduite à tenir face aux patients symptomatiques est bien codifiée, la place de la SVP et celle des alternatives médicamenteuses restent à préciser chez les patients asymptomatiques. Le suivi à long terme des cohortes de patients devrait permettre d’affiner la stratégie de leur prise en charge.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :