Chirurgie
Publié le 07 sep 2004Lecture 18 min
En cas de chirurgie mitrale, faut-il associer une chirurgie de l’arythmie ?
D. GRANDMOUJIN, J.-P. FAVRE et X. BARRAL, hôpital Nord, CHU, Saint-Étienne
La fibrillation auriculaire (FA) est un trouble du rythme fréquent dont l’incidence augmente avec l’âge et varie selon l’existence d’une pathologie cardiaque associée. Le chirurgien est souvent confronté à une arythmie complète par fibrillation auriculaire survenant au décours d’une chirurgie cardiaque ou en préopératoire. La pathologie mitrale apparaît être une grande pourvoyeuse de FA évoluant sur un mode chronique ou paroxystique, induisant une morbi-mortalité non négligeable. Il est apparu logique de développer des outils spécifiques permettant d’envisager une prise en charge thérapeutique de cette arythmie en association avec le geste chirurgical cardiaque princeps.
Ce travail se propose d’effectuer un état des lieux des techniques d’ablation endocardiques et épicardiques de l’arythmie complète par FA (ACFA) utilisant l’énergie de radiofréquence, contemporaines d’une chirurgie mitrale et, par extension, d’une chirurgie cardiaque, chez les patients en arythmie complète par FA. Seront ainsi abordés les aspects physiopathologiques de l’ACFA, les motivations d’une restauration du rythme sinusal, les aspects techniques, les résultats et les perspectives d’avenir.
La fréquence de l’ACFA varie selon les tranches d’âge. Dans la population générale, son incidence se situe aux alentours de 0,4 % ; elle augmente significativement avec l’âge, jusqu’à 5 % environ après 60 ans. Ce trouble du rythme, longtemps considéré comme bénin, connaît depuis quelques années un regain d’intérêt lié à une meilleure connaissance des mécanismes physiopathologiques impliqués, à une meilleure évaluation des conséquences cliniques et aux possibilités thérapeutiques pharmacologiques, cardiologiques interventionnelles et chirurgicales.
Les axes thérapeutiques peuvent s’orienter dans plusieurs directions selon que l’on considère le traitement :
- des conséquences délétères de la FA (anticoagulation, inotropisme sélectif) ;
- préventif des rechutes (cardioversion pharmacologique ; cardioversion externe ou interne par défibrillateur auriculaire implantable) ;
- curatif qui dépend de l’existence de pathologies cardiaques associées dans 80 % des cas (valvulopathie le plus souvent mitrale, coronaropathie, cardiomyopathie hypertrophique, tumeur intra-auriculaire, malformations congénitales telle la communication interauriculaire, amylose cardiaque, fibrose endomyocardique, etc.).
Cependant, dans 20 % des cas, on parle de FA isolée car non liée directement à une pathologie cardiaque. Cette entité regroupe de multiples étiologies telles que l’hyperthyroïdie, la bronchopneumopathie chronique, les dysfonctions sinusales et les syndromes de préexcitation.
Mécanismes et conséquences de l’ACFA
Mécanismes électrophysiologiques
Deux mécanismes principaux ont été identifiés dans la genèse des arythmies auriculaires, liés à des anomalies de l’influx ou de sa propagation.
Un automatisme anormal ou d’une activité déclenchée par des postdépolarisations précoces (EADs) ou tardives (DADs). En revanche, les anomalies de propagation de l’influx procèdent de phénomènes de réentrée, essentiellement liés à un mouvement circulaire ou plus rarement par réflexion.
Plus récemment, ont été incriminés des phénomènes d’anisotropie qui intègrent l’orientation des fibres myocardiques avec la vitesse de propagation.
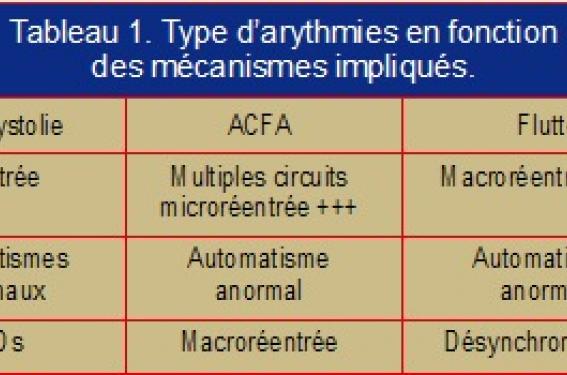
Ainsi, l’existence de plusieurs mécanismes potentiellement impliqués se traduit par l’induction de plusieurs types d’arythmies (tableau 1).
Quelles que soient les hypothèses électrophysiologiques retenues, leur expression nécessite des conditions favorables en rapport avec une vulnérabilité auriculaire, correspondant à deux facteurs principaux : les troubles de la conduction intra-auriculaire et le raccourcissement des périodes réfractaires, d’où une diminution des vitesses de propagation favorisant la formation de boucles de réentrée. Ces deux facteurs revêtent une importance majeure dans la compréhension et l’interprétation des résultats rythmologiques après thérapeutique médicale ou chirurgicale.
À ces deux facteurs essentiels de vulnérabilité auriculaire viennent s’ajouter la notion de masse critique et les effets du système nerveux autonome.
Conséquences histologiques de la FA
De multiples études ont confirmé l’existence de lésions histologiques induites par les arythmies et les tachycardies prolongées, qui peuvent pérenniser les anomalies rythmiques. À l’échelle tissulaire, on met en évidence une hypertrophie des myocytes avec ou sans fibrose, ainsi qu’une modification de l’architecture cellulaire. On remarque habituellement un élargissement du noyau, une augmentation de la teneur en glycogène, du nombre et de la taille des mitochondries. Ces anomalies histologiques s’étendent également aux structures ventriculaires.
Si la désynchronisation de l’activité électrique se traduit à l’étage auriculaire par une activation aléatoire et anarchique du tissu auriculaire, sans efficacité contractile et perte du transport atrial, elle induit également une réponse ventriculaire particulière qui justifie la prise en charge thérapeutique médicale ou chirurgicale de l’ACFA.
Conséquences cavitaires de l’ACFA
Étage auriculaire.
Si la survenue d’une arythmie supraventriculaire se traduit à l’évidence par une désynchronisation de l’activation électrique du tissu auriculaire (activation aléatoire et anarchique), l’activation désordonnée de ce tissu implique une cascade de conséquences justifiant les implications thérapeutiques actuelles :
- remodelage électrophysiologique, d’où un raccourcissement des périodes réfractaires ;
- disparition du transport atrial par perte de la systole auriculaire efficace (étirement des fibres), d’où stase sanguine (thrombus, risque embolique) ;
- augmentation de la pression intra-auriculaire (mécanisme adaptatif) ;
- dilatation des oreillettes ;
- hypersécrétion de facteur atrial natriurétique.
Réponse ventriculaire.
L’étage ventriculaire demeure particulièrement concerné par la pérennisation d’une activation électrique désynchronisée en amont du nœud auriculo-ventriculaire (A-V), lequel agit comme un filtre à l’égard des impulsions auriculaires multiples et asynchrones. La réponse ventriculaire dépendra ainsi des propriétés intrinsèques des voies de conduction, mais aussi du système nerveux autonome, et se traduira par :
- la survenue aléatoire des complexes ventriculaires : troubles de la relaxation ventriculaire avec défaut de remplissage du ventricule et diminution du volume systolique d’éjection, avec pour corollaire une altération des capacités contractiles du ventricule ;
- chute du débit cardiaque de 15 à 30 % ;
- remodelage ventriculaire (troubles de relaxation diastolique) ;
- réversibilité de la dysfonction ventriculaire gauche après restauration du rythme sinusal ;
- modification de la fréquence cardiaque : il peut s’agir d’un mécanisme d’adaptation à la dépression inotrope induite par l’activation aléatoire du ventricule. Cette réponse chronotrope pourra s’effectuer selon un mode brady- ou tachyarythmique. Les bradyarythmies relèvent le plus souvent d’une dépression exacerbée de la conduction au sein du nœud A-V, voire, plus rarement, à l’étage infranodal.
Parallèlement à ces modifications évidentes des propriétés chronotropes du myocarde ventriculaire, il est fréquent de constater une extrasystolie ventriculaire liée à des phénomènes d’échappement, de bloc de branche incomplet ou de conduction rétrograde au sein du nœud A-V.
La survenue d’une ACFA implique des conséquences hémodynamiques indiscutables et génère des éléments de morbidité péjoratifs. C’est la raison pour laquelle l’arsenal thérapeutique s’est rapidement développé tant sur le versant cardiologique que chirurgical, en particulier depuis les travaux de Cox.
ACFA et chirurgie cardiaque
La survenue d’une ACFA peut être la conséquence d’une chirurgie cardiaque ou préexister avant une intervention cardiaque. Si l’efficacité du traitement pharmacologique a fait ses preuves, notamment depuis l’apparition des molécules de classe III, elle peut parfois trouver ses limites dans certaines configurations pathologiques en raison de contre-indications relatives ou absolues qui en restreignent l’utilisation. Parallèlement, depuis quelques années nous avons assisté à une expansion de la cardiologie interventionnelle, qui a bénéficié des progrès de la technologie autorisant des champs d’application essentiellement dans deux domaines, préventif et curatif. Citons la cardioversion externe, les défibrillateurs internes et les approches endocavitaires utilisant une énergie de radiofréquence, essentiellement axées sur le versant auriculaire droit en dépit de certains travaux menés par Haissaguerre au sein des cavités gauches, mais qui se heurtent actuellement à des problèmes techniques évidents.
Ainsi, compte tenu d’un abord chirurgical nécessaire au traitement d’une valvulopathie, il était séduisant pour le chirurgien d’envisager d’étendre naturellement à l’oreillette gauche, en cas de geste mitral, une procédure complémentaire de cloisonnement auriculaire.
Interventions de Cox
Les travaux de Guiraudon, Cox et Boineau, outre une approche physiopathologique des mécanismes de l’ACFA, ont apporté une solution chirurgicale adaptée à travers les interventions de Cox-maze (I ; II ; III) et leurs variantes. Cette intervention, dans son principe, consiste en la réalisation d’incisions chirurgicales obéissant à une topographie précise, permettant un cloisonnement biauriculaire ou monoauriculaire gauche (hémi-maze) aboutissant à une canalisation de l’influx électrique et un barrage des activations parasites.
Si les résultats rythmologique (restauration du rythme sinusal), mécanique (restauration d’un transport atrial) et hémodynamique (amélioration des performances contractiles) de l’intervention de maze sont indéniables, un certain nombre de critiques ont cependant émané de la communauté chirurgicale.
Premières critiques
Outre qu’elle requiert une courbe d’apprentissage rigoureuse, cette intervention augmente significativement le temps de clampage aortique, donc la durée d’ischémie myocardique. Cette remarque se justifie d’autant plus qu’elle ne représente qu’une partie de l’intervention car elle s’intègre habituellement dans une intervention valvulaire.
La réalisation d’incisions multiples induit un risque hémorragique supplémentaire, même si les expériences relatées ne semblent pas y faire référence.
Par ailleurs, elle se heurte à un paradoxe relatif : « l’allongement des durées d’ischémie myocardique nécessite d’inclure en première intention des patients sans dysfonction ventriculaire majeure. Or, les patients les plus susceptibles de bénéficier d’une restauration en rythme sinusal se situent parmi ceux porteurs d’une altération initiale des performances contractiles ».
En outre, un certain nombre de dysfonctions sinusales temporaires ou définitives ont été rapportées.
Modifications et simplification techniques
Ces critiques spécifiques ont rapidement abouti à des modifications techniques dont le but était de simplifier la technique à travers un cloisonnement monoauriculaire (droit ou gauche) en fonction de la pathologie valvulaire sous-jacente et des données électrophysiologiques éventuellement disponibles. Cette simplification technique autorise une réduction du temps d’ischémie myocardique et donc une possibilité d’extension des procédures chirurgicales antiarythmiques aux patients « fragiles ».
Le principe de cette simplification technique et du gain de temps attendu reposait sur la possibilité d’effectuer un cloisonnement similaire à la procédure de Cox-maze, sans recours à des incisions chirurgicales. La lésion tissulaire suivie d’un processus cicatriciel nécessite ainsi le recours à une énergie reposant principalement sur un courant de radiofréquence. Ce principe de « cloisonnement énergétique » est largement utilisé dans le domaine de la cardiologie interventionnelle rythmologique.
L’approche chirurgicale du « cloisonnement énergétique » par radiofréquence est actuellement envisagée selon deux modalités d’application, endocardique et épicardique, en association à une chirurgie valvulaire mitrale et/ou tricuspide, coronarienne ou valvulaire aortique.
Ces deux derniers cas de figures justifient pleinement une approche épicardique car liés à l’absence d’ouverture des cavités auriculaires.
Cloisonnement par radiofréquence
Principe de la radiofréquence
Le principe de l’énergie de radiofréquence est utilisé en pratique depuis près de 50 ans. Il s’apparente au bistouri électrique classiquement utilisé en chirurgie et réalise une coagulation des protéines de structure aboutissant à la formation de lésions linéaires profondes histologiquement uniformes et bien délimitées. Cette lésion tissulaire fait l’objet d’un processus cicatriciel secondaire, essentiel à la compréhension des phénomènes de récidives potentielles décrits après procédures de cloisonnement auriculaire et liés à des modifications des périodes réfractaires dépendant de la taille des circuits de réentrée.
Approche endocardique (chirurgie mitrale et/ou tricuspide).
Deux dispositifs de radiofréquence endocardique sont actuellement disponibles (figure 1) :
- Boston Scientific/EP Technologies (sondes Thermaline® et Cobra®) ;
- Medtronic (système Cardioblate®).
Ces systèmes font appel à une sonde électrochirurgicale monopolaire stérile à usage unique permettant une coagulation des tissus par contact direct avec contrôle des paramètres de température, de puissance, de durée et d’impédance tissulaire. Les sondes utilisées sont reliées à un générateur de radiofréquence. Ces deux systèmes varient cependant par les modalités d’interface tissus/sonde.
A : Sonde Cobra® et générateur spécifique (Boston Scientific. EP Technologies)
B : Sonde Cardioblate® et générateur spécifique sonde unipolaire irriguée (Medtronic)
Figure 1. Sondes monopolaires et générateurs de radiofréquence endo-auriculaire.
Approche épicardique (chirurgie mitrale, coronarienne, valvulaire aortique).
Cette approche, rendue possible initialement par l’utilisation de sondes monopolaires type Thermaline® (Boston Scientific EP Technologies), a connu récemment le développement de sondes bipolaires spécifiques. Elle représente un gain de temps et de facilité technique appréciable ainsi qu’un confort chirurgical majeur en configuration « cœur battant ».
Deux sondes bipolaires autorisant un encerclement des veines pulmonaires sont actuellement disponibles avec des temps d’application variant de 15 (Medtronic) à 30 s (Boston-Scientific) (figure 2 A et B).
A : Isolement épicardique des veines pulmonaires par sonde bipolaire (principe et aspects opératoires).
B : Sonde bipolaire (Boston Scientific)
C : Sonde bipolaire (Medtronic)
Figure 2. Sondes bipolaires et principe de l'isolement épicardique des veines pulmonaires (approche minimaliste).
Aspects lésionnels histologiques
La destruction tissulaire intervient à partir de 45 °C. Les lésions physiques induites peuvent être schématiquement scindées en deux groupes.
Les lésions de coupure par évaporation des liquides intracellulaires apparaissent à une température > 100 °C.
Les lésions de coagulation avec dénaturation des protéines aboutissent à une perte des fonctions cellulaires, sans séparation (coupure) tissulaire, et apparaissent à des températures comprises entre 60 et 80 °C. L’épaisseur des lésions semble proportionnelle à la durée, à la température et à la puissance programmées et varie entre 2 et 3 mm pour une température de 70 °C pendant 60 s, incluant les lésions directes et indirectes par diffusion thermique. Les lésions induites se caractérisent par une coagulation des protéines, une dégénérescence des myocytes et une disparition des adipocytes.
Aspects techniques chirurgicaux
Cloisonnement auriculaire endocardique
Cette approche nécessite une ouverture de l’oreillette gauche et éventuellement de l’oreillette droite. Elle s’inscrit ainsi, en toute logique, dans une chirurgie valvulaire mitrale et/ou tricuspide. Elle permet au chirurgien un contrôle total du patron lésionnel issu du cloisonnement énergétique par radiofréquence. Ce dernier aspect est essentiel afin de positionner parfaitement les lignes de cloisonnement autour des veines pulmonaires sans risquer une sténose résiduelle, et de cibler en toute sécurité l’isthme gauche ainsi que le toit de l’oreillette gauche.
Topographie des lésions de cloisonnement endocardique.
La définition des lignes de lésions s’inspire directement des incisions chirurgicales décrites par Cox. On distingue ainsi le cloisonnement endocardique de l’oreillette gauche (figures 3A et 3B) et le cloisonnement endocardique de l’oreillette droite (figure 4). L’association systématique d’un temps auriculaire droit ne semble pas actuellement justifiée en raison d’une localisation des foyers de réentrée largement prédominante (80 à 90 %) au niveau des veines pulmonaires.
Facteurs conditionnant les lésions.
Les lésions induites se caractérisent par deux critères, la taille et la profondeur.
A : Cloisonnement de l'oreillette gauche
Lignes rouges : topographie des tirs de radiofréquence
B : Aspect opératoire
Lignes bleues : lésions de radiofréquence
Figure 3. Topographie lésionnelle du cloisonnement endo-auriculaire gauche.
Figure 4. Topographie lésionnelle du cloisonnement endo-auriculaire droit. Trait bleu : topographie des tirs de radiofréquence.
Ainsi, la température du tissu auriculaire demeure un paramètre physique fondamental quant à la caractérisation du processus lésionnel amenant à moduler les paramètres d’ablation en fonction du type de protection myocardique (cardioplégie chaude intermittente ou continue/cardioplégie froide) et de la température de circulation extracorporelle.
De même, l’épaisseur du tissu auriculaire variant selon l’ancienneté de la valvulopathie mitrale, de l’ACFA mais également du patient (âge, réintervention), l’opérateur doit intégrer dans l’obtention d’une lésion transmurale les variations de ces mêmes paramètres d’ablation, gage d’un résultat rythmologique et hémodynamique optimisé.
Risques potentiels d’une procédure de cloisonnement endo-auriculaire gauche
On peut distinguer deux types de risques se différenciant par leur chronologie de survenue.
Les risques immédiats sont dominés par :
- la perforation auriculaire se traduisant par un hémopéricarde immédiat ou semi retardé, lié dans ce cas à une chute d’escarre quelques jours après l’intervention ;
- la lésion de l’artère circonflexe, principalement dépendante d’une topographie de cloisonnement inadéquate. Bien que non rapportée, cette complication reste possible ;
- la perforation œsophagienne, qui obéit à la conjonction de plusieurs facteurs prédisposants. Elle a effectivement été rapportée et semble se produire lors de la réalisation du trait de cloisonnement jonctionnel entre les deux îlots des veines pulmonaires droites et gauches.
Les risques retardés, essentiellement dominés par une sténose cicatricielle de veine pulmonaire. Cette complication grave rapportée lors de procédures d’ablation endocavitaire n’a pas été décrite lors des procédures de radiofréquence chirurgicale.
Le cloisonnement épicardique
Il s’agit d’une procédure réalisée à cœur battant, avec ou sans circulation extracorporelle. Elle se distingue par deux concepts : « maximaliste » et « minimaliste ».
Le « concept maximaliste » : cette approche, que l’on pourrait qualifier d’intégrale ou de maximaliste, permet la réalisation de l’ensemble des lignes lésionnelles issues de l’intervention classique du labyrinthe (Cox-maze). Elle respecte ainsi les principes édictés par Cox et permet un cloisonnement complet de l’oreillette gauche incluant un geste préventif à l’égard d’une récidive de flutter par l’intermédiaire d’un trait lésionnel centré sur l’isthme gauche. Cette approche particulière fait appel principalement à des sondes monopolaires type Cobra® (Boston Scientific) (figure 5).
Isolement de l'auricule gauche
Isolement de l'isthme gauche
Figure 5. Topographie des lignes lésionnelles épicardiques réalisées par sonde monopolaire et vues opératoires (approche maximaliste).
Il est fondamental que la procédure de radiofréquence épicardique se déroule sur des cavités auriculaires pleines sous peine d’un risque de perforation.
Le « concept minimaliste » : si l’isolement des veines pulmonaires droites et gauches ne pose pas de problème technique majeur au chirurgien, la réalisation complète de l’ensemble des lignes lésionnelles a souvent fait l’objet de critiques quant à leur faisabilité et reproductibilité, car elles nécessitent des manœuvres de mobilisation cardiaque plus ou moins importantes liées à une dissection de difficulté variable en raison de l’utilisation des sondes monopolaires habituelles. Par ailleurs, lors de réinterventions, si l’isolement des veines pulmonaires semble relativement accessible, la réalisation des lignes additionnelles est techniquement plus audacieuse, voire risquée.
L’ensemble de ces considérations a amené certaines équipes à ne proposer qu’un isolement des veines pulmonaires droites et gauches tout en supprimant les manœuvres de luxation cardiaque.
Cette simplification du geste, rendue possible grâce aux développements des sondes bipolaires, ouvre des perspectives intéressantes, notamment en cas de réinterventions ou de procédures de revascularisation myocardique sans CEC. En outre, elle s’accompagne d’une diminution conséquente du temps d’application de la sonde qui se réduit à 30 s avec les sondes bipolaires contre 2 min avec les sondes monopolaires habituelles, ce qui représente un confort chirurgical non négligeable sur un cœur battant. Elle s’inscrit aussi dans le schéma des procédures mini-invasives et préfigure la réalisation de gestes sous thoracoscopie, voire assistés par robotique.
En revanche, il reste à démontrer à l’avenir, par des études prospectives randomisées, que l’efficacité rythmologique d’un isolement simple des veines pulmonaires par sonde bipolaire est équivalente à une procédure épicardique classique (maximaliste) associant toutes les lignes lésionnelles.
Prise en charge pharmacologique postopératoire
La réalisation d’un geste valvulaire mitral isolé induit en postopératoire immédiat des événements rythmiques dominés par la survenue d’épisodes d’ACFA dans 15 à 30 % des cas, indépendamment de leur existence préalable. Il n’est donc pas surprenant de constater la survenue dans les mêmes proportions d’une ACFA précoce après correction d’une valvulopathie mitrale associée à une procédure de cloisonnement par radiofréquence. Il est, en effet, illusoire de penser que l’association d’une procédure antiarythmique à l’étage supraventriculaire va immédiatement supprimer la survenue d’événements rythmiques. De tels événements sont multifactoriels (CEC, lésions coronariennes, régimes de pression intra-auriculaire modifiés, etc.). D’un point de vue hémodynamique et rythmologique, l’expérience démontre une supériorité évidente de la stimulation en mode double chambre qui permet, en cas de nécessité, une resynchronisation auriculo-ventriculaire précoce et une vidange atriale effective.
On a vu précédemment que le cloisonnement par radiofréquence induit une cicatrisation retardée vers le 3e mois postopératoire, au même titre d’ailleurs que la cicatrisation d’une auriculotomie classique. Durant ce premier trimestre postopératoire, il y aura des modifications évidentes de la géométrie auriculaire en rapport avec les lignes de cloisonnement, la récupération d’un transport atrial, la correction de la pathologie mitrale et de probables modifications histologiques induites par la restauration d’un rythme sinusal. D’un point de vue électrophysiologique, les cavités auriculaires apparaissent vulnérables, durant cet intervalle de temps, en raison de la modification des périodes réfractaires. À l’instar d’une chirurgie valvulaire mitrale isolée qui requiert une « couverture » antiarythmique habituelle à des posologies assez standardisées (amiodarone : 300 mg ; sotalol : 120 mg), il apparaît important de conserver une prévention pharmacologique similaire durant 3 à 6 mois.
L’appréciation du résultat rythmologique doit être différée entre le 3e et le 6e mois.
En cas de récidives précoces avec retentissement hémodynamique, « l’agressivité » thérapeutique doit néanmoins demeurer une règle, d’autant plus que la capacité contractile du myocarde est altérée.
Résultats et perspectives des procédures chirurgicales de cloisonnement auriculaire
Plus de 6 000 cas opératoires ont actuellement été effectués en Europe, incluant majoritairement des approches endocardiques, plus rarement des approches épicardiques en raison de leur caractère plus récent.
Morbi-mortalité
La mortalité hospitalière, quelles que soient les expériences publiées, demeure comparable à celle de la chirurgie valvulaire mitrale, aortique ou coronarienne classique. Cela implique que l’adjonction d’une procédure rapide et efficace telle que le cloisonnement par radiofréquence endo-auriculaire ne génère pas un surcroît de complications spécifiques, tant sur le plan hémorragique que myocardique avec, en revanche, des durées moyennes de cloisonnement variant de 15 à 25 min, ce qui représente un gain de temps très significatif comparativement à la procédure de Cox-maze.
En revanche, l’approche endocardique a suscité initialement quelques inquiétudes en raison de rares cas de perforations œsophagiennes. L’analyse objective a amplement démontré que ces complications étaient liées à un geste technique imparfait et inadéquat qui, dans la plupart des cas, n’avait pas pris en compte les précautions d’usage, à savoir protection mécanique de l’œsophage et retrait systématique de la sonde d’ETO.
Résultats rythmologiques
Ils sont appréciés entre le 3e et le 6e mois postopératoires. Dans près de 30 à 50 % des cas, on note la survenue de récidives d’ACFA précoces au cours des 3 premiers mois postopératoires, qui ne présagent pas du résultat rythmologique définitif et traduisent simplement une vulnérabilité auriculaire patente. Ces récidives justifient, en revanche, une attitude thérapeutique adaptée, voire « agressive », par cardioversion externe en cas de mauvaise tolérance.
Les résultats à partir du 3e mois postopératoire dépendent du type d’ACFA, paroxystique ou chronique, et surtout de la taille préopératoire de l’oreillette gauche qui semble être actuellement le véritable facteur prédictif d’échec.
Le tableau 2 collige, à partir de l’ensemble des cas effectués en Europe, les résultats rythmologiques en termes de restauration et de maintien en rythme sinusal en fonction du type d’ACFA et de la taille de l’oreillette gauche.
Contraction auriculaire
Une contraction auriculaire efficace avec transport atrial est retrouvée dans plus de 90 %.
Dysfonction sinusale
L’incidence de cette complication, rapportée après procédure de Cox-maze et partiellement liée aux lignes d’incision, devrait diminuer après radiofréquence en raison du déplacement des lignes de cloisonnement endo-auriculaire, mais également du caractère probablement moins vulnérant.
Cependant, la survenue d’une dysfonction sinusale demeure toujours une possibilité en raison de la diversité des facteurs déclenchants qui dépendent, outre du placement, des lignes de cloisonnement, de l’adjonction d’un temps auriculaire droit, de tractions auriculaires excessives, de traumatismes divers, du placement des canules de drainage cave, du type de protection myocardique, de l’association de lésions coronariennes, de désordres électrolytiques, voire de l’action conjuguée de molécules antiarythmiques ou d’agents sympatholytiques.
En outre, la possibilité d’une dysfonction sinusale méconnue en préopératoire, car masquée par l’ACFA et liée à des lésions de fibrose auriculaire, demeure une éventualité non négligeable, en particulier lors d’arythmie ancienne. Cette dysfonction sinusale justifie l’implantation d’électrodes épicardiques auriculaire et ventriculaire autorisant une stimulation temporaire en mode double chambre et permettant également une resynchronisation des deux étages auriculaire et ventriculaire pour une optimisation hémodynamique.
Conclusion
Les travaux de Cox et Boineau ont permis de réaliser des progrès indéniables dans la prise en charge des arythmies supraventriculaires associées à des pathologies cardiaques relevant d’une sanction chirurgicale. Une évolution des modalités techniques s’est rapidement imposée en raison de contraintes évidentes liées à une courbe d’apprentissage rigoureuse, au caractère invasif du cloisonnement chirurgical des oreillettes et à son cortège potentiel de complications périopératoires.
L’apport de l’énergie de radiofréquence a représenté une étape majeure quant aux possibilités de reproduire, selon des variantes anatomiques, les incisions décrites par Cox, sans majoration importante des durées d’ischémie myocardique, et en diminuant les risques hémorragiques. Le chirurgien a ainsi pu rapidement étendre les indications de cloisonnement mono- ou biauriculaire aux patients présentant une altération des performances contractiles liée à la pérennisation d’une fibrillation auriculaire conjuguée à une pathologie cardiaque, essentiellement représentée par une valvulopathie mitrale.
La prise en charge chirurgicale d’une pathologie cardiaque associée à une arythmie supraventriculaire constitue un domaine d’action nouveau pour le chirurgien cardiaque, tant sur le plan culturel que technique, et devra certainement s’intégrer dans un profil de collaboration incluant la cardiologie interventionnelle (procédures hybrides), la recherche technologique à travers le développement d’énergies nouvelles en voie d’expérimentation (cryo-ablation, micro-ondes, laser), des réflexions sur la sélection des patients, la détermination de facteurs prédictifs d’échec et l’évolution des techniques chirurgicales.
Si le nombre de procédures régulièrement effectuées démontre l’intérêt croissant de la communauté chirurgicale à l’égard de cette technique simple, sûre et efficace, l’intérêt d’études prospectives multicentriques n’en demeure pas moins capital et permettra une appréciation rigoureuse des résultats à long terme.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :