Publié le 09 mai 2006Lecture 2 min
Primo CABG II
A. MARQUAND, Saint-Raphaël

ACC
P.-K. Smith a présenté les résultats de PRIMO CABG II (Pexelizumab for the reduction of Infarction and Mortality – Coronary Artery Bypass Graft surgery), une étude évaluant un inhibiteur du système du complément nommé pexelizumab, visant à réduire les infarctus et décès après pontages aorto-coronaires.
Le pexelizumab est un anticorps qui bloque le clivage du facteur C5 en ses deux composants, C5a et C5b-9, possédant tous deux des effets délétères au niveau vasculaire et myocardique. Après injection, l’inhibition est maximale dès la 4e h, puis dure 24 h avant de voir l’activité du complément se normaliser progressivement sur 72 h.
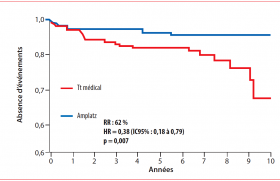
L’étude PRIMO CABG I avait déjà montré avec le même produit une tendance à moins de décès et d’infarctus, et une réduction significative des infarctus après pontage. L’analyse post-hoc montrait que le bénéfice s’observe surtout chez les patients ayant au moins deux facteurs de risque. L’étude actuelle porte sur 4 254 patients randomisés pour recevoir le pexelizumab en bolus puis infusion ou le placebo, dans le cadre d’une chirurgie coronaire. Le critère d’évaluation principal est la somme des décès et infarctus à J30. Les patients devaient avoir au moins deux facteurs de risque tels qu’une chirurgie urgente, la présence d’un diabète, le sexe féminin, des antécédents d’insuffisance cardiaque, d’infarctus, d’AVC ou de pontage. Les résultats figurent dans le tableau.
L’analyse en sous-groupes montre des résultats consistants. La tolérance du produit est bonne, sans différence significative par rapport au placebo, en dehors d’une réduction significative des cas de septicémie sous pexelizumab.
Cette étude ne valide donc pas le critère principal d’évaluation spécifié. Toutefois la réduction de décès a amené les auteurs à réaliser une métaanalyse des trois études disponibles en chirurgie cardiaque, qui fait alors apparaître une réduction significative des décès de 21 % (p = 0,043). Ce résultat encourageant amènera probablement à poursuivre les études de développement avec ce produit.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :