Rythmologie et rythmo interventionnelle
Publié le 06 nov 2007Lecture 8 min
RHYTHM 2007 : les techniques invasives en vedette
C. BERTRAND, CMC Parly 2, Le Chesnay
Ce congrès de rythmologie a pour vocation l’enseignement et la mise au point sur les diverses techniques invasives et s’appuie sur de nombreuses vidéos retransmissions en direct. Les principaux thèmes scientifiques abordés ont été : les facteurs de risque de mort subite dans les syndromes du QT long et de Brugada, le suivi postimplantation des défibrillateurs automatiques implantables (DAI), le DAI sous-cutané, la resynchronisation cardiaque (CRT), la fibrillation atriale (FA) sous ses différents aspects et une nouvelle technique chirurgicale d’ablation de la FA : EPICOR.
Les congressistes ont pu en particulier assister en direct à une ablation de fibrillation auriculaire (A. Pisapia et M. Bremondy) et à une ablation de tachycardie ventriculaire infundibulaire (J.-F. Leclercq et F. Halimi) utilisant toutes deux les dernières techniques de cartographie tridimensionnelle.
Suivi postimplantation des DAI
Les principales complications dans le suivi opératoire d’un défibrillateur automatique implantable (DAI) sont tout d’abord :
- l’anxiété,
- la dépression (un suivi psychologique peut être nécessaire),
- les problèmes de cicatrisation,
- les défauts de programmation des dispositifs avec modification des zones de thérapie, optimisation des ATP délivrés, des chocs inappropriés avec nécessité parfois de faire évoluer le DAI simple en double chambre (on peut d’ailleurs se demander s’il n’est pas justifié d’implanter systématiquement en double-chambre les patients en rythme sinusal).
Le traitement antiarythmique ne doit pas être arrêté en postimplantation. Il doit être poursuivi et même renforcé en cas de choc. Les antiarythmiques peuvent diminuer l’amplitude du signal détecté dans les deux chambres, augmenter le seuil de stimulation et de défibrillation. Certaines tachycardies peuvent ainsi être sous-détectées et non traitées efficacement par le dispositif. L’ablation peut être envisagée en cas d’orage rythmique ventriculaire.
DAI sous-cutané
La technique consiste à implanter une électrode de défibrillation par voie sous-cutanée et non endovasculaire, ce qui permettrait de prévenir les complications vasculaires à long terme. Ce concept n’est pas nouveau puisqu’il est déjà utilisé chez les enfants et chez des patients ayant une anatomie complexe.
La technique opératoire consiste en la pose du DAI dans une poche prépectorale et l’implantation de la sonde de défibrillation sous-cutanée au 5e espace intercostal à 3 cm du bord gauche du sternum.
Les avantages sont un temps d’implantation plus court et donc moins d’infections, une extraction du dispositif plus facile en cas de nécessité, l’absence d’irradiation et un apprentissage à la technique plus rapide.
Les inconvénients sont l’absence de fonction pacing. Cette technique n’est donc pas indiquée en cas de bradycardie, d’indication à la resynchronisation ou de TV réduites par de la stimulation (ATP).
Les indications sont la prévention primaire des troubles du rythme ventriculaire (MADIT II, SCD-Heft, Brugada, cardiomyopathie hypertrophique, dysplasie ventriculaire droite arythmogène).
Facteurs de risque de mort subite dans les syndromes du QT long et de Brugada
Le syndrome du QT long
Les facteurs de risque de mort subite dans le syndrome du QT long sont :
- un QTc > 500 ms (LQT1 et 2),
- les LQT3 de sexe masculin.
Le traitement du syndrome du QT long est tout d’abord médicamenteux (bêtabloquants). L’indication de DAI en prévention primaire est reconnue pour les LQT3 avec QTc > 500 ms et de sexe masculin, pour les LQT2 avec QTc > 500 ms sous bêtabloquants et de sexe féminin. L’indication de DAI en prévention secondaire est tout syndrome du QT long restant symptomatique sous bêtabloquants, les morts subites récupérées et les syndromes symptomatiques avant l’âge de 7 ans, ce qui pose des problèmes techniques majeurs.
Le syndrome de Brugada
Le risque de mort subite dans ce syndrome est accru :
- la nuit,
- en cas de fièvre,
- chez les hommes jeunes < 40 ans (risque x 5,5),
- chez les sujets symptomatiques,
- en présence d’un aspect ECG de type 1 spontané (risque x 7,7).
Le génotype n’influe pas sur le pronostic. Suivant les études, l’exploration électrophysiologique (EEP) avec la stimulation ventriculaire programmée (SVP) influe sur le pronostic. Pour J. Brugada (Circulation, 2003), le résultat de l’EEP est un facteur pronostique avec un risque augmenté de mort subite chez les sujets inductibles. En revanche, Eckart (Circulation 2005) ne retrouve pas de différence significative en termes de pronostic que les sujets soient inductibles ou non. Dans tous les cas, un dépistage familial est indispensable dans le syndrome de Brugada.
Resynchronisation cardiaque (CRT) et FA
Quelque 20 % des patients en insuffisance cardiaque (IC) développent une FA dans les 4 ans (Wang, Circulation 2003). Les sujets en NYHA classe III et IV représentent la majeure partie d’entre eux. Les recommandations actuelles de la CRT (classe I, niveau de preuve A) excluent les sujets en FA. Les indications sont les patients en rythme sinusal, ayant une FEVG < 35 %, une cardiomyopathie ischémique ou non, des QRS élargis > 120 ms, en classe III et IV de la NYHA et ayant un traitement médical optimal de l’insuffisance cardiaque. Gasparini a mis en évidence un bénéfice plus marqué de la CRT en cas de FA chronique chez les patients ayant une ablation de His. La CRT ne diminue pas l’incidence de FA (étude HOPE).
FA et IC : stratégie de contrôle de la fréquence par ablation du His et CRT
L’étude AFFIRM (Atrial Fibrillation Follow-up Investigation of Rhythm Management) n’a pas montré de diminution de la mortalité lors du rétablissement du rythme par rapport au ralentissement. L’ablation de la jonction auriculoventriculaire améliore les symptômes, la qualité de vie et la FEVG au risque que le patient devienne stimulo-dépendant et puisse par ce fait être désynchronisé. Dans ce cas, une resynchronisation biventriculaire doit être envisagée pour éviter une désynchronisation liée à la stimulation du ventricule droit. L’étude PAVE, a mis en évidence une amélioration de la FEVG et du test de marche de 6 minutes après ablation du His et resynchronisation cardiaque. Les résultats sont équivalents dans le groupe ablation-resynchronisation et rétablissement du rythme sinusal pour ces critères. Chez un patient en FA et en insuffisance cardiaque, le but est de ralentir sa fréquence cardiaque par les médicaments. L’ablation de la jonction nodo-hisienne doit rester une exception chez les patients insuffisamment ralentis et doit a priori s’accompagner d’une resynchronisation ventriculaire systématique au préalable.
Mécanismes initiateurs et perpétuateurs de la FA
Haïssaguerre en 1996 a démontré le rôle crucial des veines pulmonaires en tant que zone gâchette (trigger) de la FA. Cela est dû à l’enchâssement du myocarde atrial dans l’ostium des veines pulmonaires. L’anatomie des veines pulmonaires varie beaucoup d’un patient à l’autre. Il existe dans un tiers des cas un vestibule commun à deux veines pulmonaires. L’éperon postéro-latéral entre la veine postéro-supérieure et l’auricule gauche est une zone musclée, riche en trabéculations et difficile d’accès à l’ablation. La veine de Marshall, la veine cave supérieure, le septum interatrial et le sinus coronaire peuvent également être arythmogènes en raison de leur situation anatomique et de leur musculature. Le système nerveux autonome (sympathique et parasympathique) peut être initiateur et perpétuateur de la FA. Par ailleurs, l’hyperactivation du système rénine-angiotensine est à l’origine de la synthèse de collagène et du remodelage atrial.
Les mécanismes de la FA
Ce sont une origine focale, de multiples ondes de réentrée et des « rotors mère » entraînant des « réentrées filles ». Les veines pulmonaires peuvent être responsables de la FA par automaticité, trigger ou réentrée. L’alternance cycle court-cycle long joue un rôle arythmogène dans le déclenchement de la FA. En effet, la survenue d’extrasystoles atriales engendre une hétérogénéité des périodes réfractaires de l’OG. Les veines pulmonaires et le remodelage atrial sont sources et perpétuateurs de la FA. Déconnecter les veines pulmonaires ne suffit donc pas dans certains cas (FA persistante et permanente). Il faut réduire la masse atriale en créant des lignes et en tirant sur les zones fragmentées de l’OG. L’initiation ou le maintien de la FA dépend de triggers automatiques ou de réentrées (vaguelettes multiples et rotor mère) ou les deux (Jalife).
Les complications de l’ablation de la FA
Les complications majeures sont le décès (0,05 %), la tamponnade (1,2 %), la sténose de veine pulmonaire (1,63 %), l’AVC (0,28 %), l’AIT (0,66 %), la sténose œsophagienne et la fistule atrio-œsophagienne (< 0,25 %), le sepsis (0,01 %), le pneumothorax (0,02 %), l’hémothorax (0,16 %), la dissection aortique (0,03 %), la fistule artério-veineuse (0,4 %), le pseudo-anévrisme fémoral (0,5 %) et la paralysie diaphragmatique chronique (0,11 %).
L’incidence de sténose des veines pulmonaires est fonction de la puissance et du temps d’application du courant de radiofréquence dans les veines. Actuellement cette complication est plus rare car les tirs se font en périphérie et non dans les veines (ablation circonférentielle et non ostiale).
Le risque thromboembolique est per- et postprocédure (pendant 2 semaines). En perprocédure, il y a un risque de thrombus dans la gaine dans l’oreillette gauche (OG) et autour du cathéter circulaire dans l’OG. La gaine et la sonde d’ablation sont irriguées, le patient est mis sous héparine non fractionnée et l’ACT est mesuré pendant la procédure (objectif supérieur à 300 secondes) pour limiter ce risque. En postintervention, l’héparine est maintenue jusqu’à ce que le patient soit bien anticoagulé sous antivitamine K.
Les lésions digestives peuvent apparaître 2 à 4 semaines après l’ablation devant l’apparition de fièvre, d’AIT récurrents ou de choc septique. Pour prévenir cette complication, la puissance de délivrance des tirs est diminuée sur la paroi postérieure de l’OG et une sonde thermique intra-œsophagienne peut être utilisée.
Les complications majeures de l’ablation de la FA ne sont pas négligeables puisqu’elles représentent plus de 5 % des procédures. Ce n’est donc pas un traitement de première intention et les patients doivent être bien sélectionnés, principalement les sujets jeunes, symptomatiques, présentant de la FA paroxystique résistant au traitement médical.
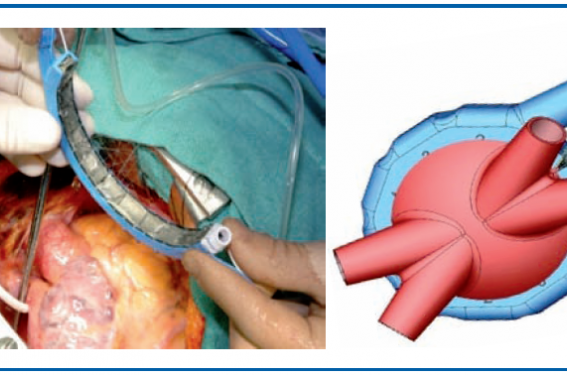
Ablation chirurgicale de FA (système EPICOR).
EPICOR
Cette nouvelle technique chirurgicale d’ablation de la FA par ultrasons utilise le système EPICOR épicardique sans CEC. Le but est d’isoler les 4 veines pulmonaires du massif atrial gauche. La technique est simple et reproductible. Durant une chirurgie cardiaque, après ouverture du péricarde, mais sans CEC, on place une ceinture autour de l’oreillette gauche (OG) au contact de l’épicarde pour isoler les veines pulmonaires de l’OG. Cette ceinture comporte des cellules émettant des ultrasons. Le système doit être irrigué pour créer une lésion transmurale. Il existe en plus de la ceinture des kits permettant de faire la ligne du toît de l’OG et l’isthme gauche pour les FA permanentes. Les avantages de cette technique sont de créer une lésion transmurale, d’être reproductible, rapide (moins de 10 min) et non dangereuse (pas de fistule atrio-œsophagienne notamment).
Plus de détails sur www.rhythmcongress.com
Congrès international organisé par A. Pisapia, P. Attuel, J.-F. Leclercq, F. Gaita et C. Barnay. Avec le patronage de la Société française de cardiologie / Accrédité par le board européen EBAC (14 heures de crédit CME)
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :