Cardiopathies congénitales
Publié le 09 juin 2009Lecture 7 min
Suivi des patients porteurs de tétralogie de Fallot en pratique
L. LEGLOAN, S. ABBEY, CHU de Nantes
La tétralogie de Fallot est la cardiopathie congénitale cyanogène complexe la plus fréquente (environ 10 % des enfants nés vivants et porteurs d’une cardiopathie congénitale).
Elle est définie par l’association d’une communication interventriculaire, d’un obstacle de la chambre de chasse du ventricule droit, valvulaire ou sous-valvulaire pulmonaire, à l’origine d’une hypertrophie ventriculaire droite et enfin d’une aorte dextroposée, à cheval entre les deux ventricules, au-dessus de la communication interventriculaire.
Du fait des progrès chirurgicaux majeurs, la survie à long terme deest dorénavant de 86 % à 32 ans (Murphy et al. NEJM 1993). Le pronostic est bon en cas de correction chirurgicale dans les deux premières années de vie, tant en termes de survie que de qualité de vie. Il existe cependant une mortalité tardive significative.
La mortalité tardive significative est essentiellement attribuée à des morts subites, dont l’incidence est estimée à 1,5 à 4,5 pour 1 000 patients-années (surtout 4 ans après la cure chirurgicale) (Steeds et al. QJM 2004). Les mécanismes incriminés sont les troubles de conduction et surtout les troubles du rythme ventriculaire.
Troubles de conduction et du rythme
Les troubles de conduction
Ils sont fréquents et peuvent intéresser tous les étages. L’anomalie la plus fréquente est le bloc de branche droit (80 à 90 % en cas de ventriculotomie, Friedli B et al. Arch Mal Coeur 1996), parfois associé à un hémibloc antérieur gauche dans 15-20 % des cas (Friedli B et al. Arch Mal Coeur 1996), et sans conséquence significative. Le bloc auriculo-ventriculaire complet est essentiellement constaté en période postopératoire, permanent ou transitoire. La survenue postopératoire immédiate d’un tel bloc, pendant plus de trois jours serait prédictive de la survenue de morts subites tardives (Hokanson et al. Am J Cardiol 2001).
Les tachycardies supraventriculaires
Elles sont fréquentes et souvent symptomatiques (mauvaise tolérance hémodynamique, insuffisance cardiaque, palpitations). L’incidence de ces tachycardies en cas de Holter ECG systématiques est de 34 %, dont deux tiers de flutter atrial ou fibrillation atriale (Roos-Hesselink J et al. Circulation 1995). Leur apparition est souvent contemporaine d’un état hémodynamique médiocre (Wessel et al. Am J Cardiol 1980).
Les mécanismes sont multifactoriels (dilatation atriale, circuits de réentrées secondaires aux incisions chirurgicales) mais les facteurs prédictifs démontrés de survenue de fibrillation ou de flutter atrial sont : l’âge tardif à la correction chirurgicale, les anastomoses palliatives de type Waterston ou Potts, les réinterventions avant 1985, l’index cardiothoracique élargi et la présence d’une régurgitation tricuspide modérée ou sévère (Gatzoulis et al. Lancet 2000).
Leur prise en charge associe ensuite un traitement anticoagulant et un traitement antiarrythmique qui peut être difficile à gérer compte tenu des troubles de conduction fréquents, et en cas d’altération de la fonction ventriculaire droite. Les nouveaux systèmes de cartographie utilisés en électrophysiologie interventionnelle (Carto® ou Navix®) permettent d’envisager très précocement une ablation par radiofréquence, d’autant qu’il s’agit le plus souvent de flutter isthmodépendant (Collins KK et al. Am J Cardiol 2000). En cas de flutters cicatriciels, les isthmes des circuits sont plus facilement localisés et une ablation par radiofréquence à ce niveau permet le plus souvent l’arrêt du flutter et l’interruption du traitement antiarythmique.
Détection du risque de mort subite
Le véritable challenge de la prise en charge de cette cardiopathie reste toutefois la sélection des patients à risque de mort subite, essentiellement par troubles du rythme ventriculaire.
Leur genèse peut être la conséquence de plusieurs facteurs, et notamment d’une fibrose spontanée de l’infundibulum pulmonaire (en témoigne son existence dans des cœurs fallotiques non réparés) ; des cicatrices chirurgicales (favorisant les sites de réentrée) ; ainsi que des surcharges de volume et de pression, conséquences des lésions anatomiques résiduelles sur les valves notamment (Zeltser et al. J Thorac Cardiovasc Surg 2005). Aussi, l’analyse de l’anatomie cardiaque apparaît fondamentale.
L’identification des patients à risque de troubles du rythme ventriculaire reste difficile et conjugue une analyse du profil rythmique et du profil hémodynamique, tout en sachant que les interactions entre les différents paramètres sont permanentes.
Différents examens permettent de mieux caractériser le profil rythmique de ces patients :
L’éléctrocardiogramme
Une durée des QRS > 180 ms est prédictive de la survenue de tachycardie ventriculaire, avec une sensibilité de 94,7 % et surtout une excellente valeur prédictive négative, proche de 100 % (Gatzoulis et al. Circulation 1995).
Holter-ECG
Sa valeur est plus difficile à préciser tant la présence d’extrasystoles ventriculaires est fréquente dans cette cardiopathie et les résultats des études discordants (Friedli. Pediatr Cardiol 1999, Khairy P et al. Circulation 2008).
Potentiels ventriculaires tardifs
Leur valeur est également difficile à interpréter tant les résultats des études sont également discordants.
Epreuve d’effort
Il est également commun de constater des troubles du rythme ventriculaire non soutenus à l’effort, surtout en cas de réparation tardive ou de statut hémodynamique précaire. Cependant, leur valeur pronostique n’est pas connue.
Stimulation ventriculaire programmée
La valeur de la stimulation ventriculaire programmée a longtemps été controversée mais une récente étude de Khairy (Khairy P et al. Circulation 2004) a montré son excellente valeur prédictive négative, lorsqu’elle est réalisée démaquillée selon un protocole de stimulation strict.
Étude du profil hémodynamique
Elle repose sur les données morphologiques, recueillies notamment par échocardiographie et par IRM cardiaque. Ces examens permettent de rechercher des fuites valvulaires résiduelles tricuspide et surtout pulmonaire.
En effet, la persistance d’une fuite pulmonaire sévère semble être l’un des marqueurs de risque les plus importants quant à la survenue de tachycardie ventriculaire (Gatzoulis MA et al. Lancet 2000). Le principal critère quantitatif justifiant sa correction chirurgicale est le volume télédiastolique du ventricule droit > 150 ml/m2 en IRM (Buechel ER et al. Eur Heart J 2005). Une fois la correction chirurgicale réalisée, il est noté une diminution de la largeur des QRS qui s’accompagne, en cas de chirurgie antiarythmique associée, d’une diminution d’incidence des troubles du rythme supraventriculaire et ventriculaire (Therrien J et al. Circulation 2001).
L’altération de la fonction ventriculaire gauche systolique est également un important facteur de risque de mort subite lorsqu’elle est < 40 % lors de l’évaluation échocardiographique (Ghai A et al. JACC 2002).
Enfin, l’IRM permet de mieux identifier l’étendue de la fibrose ventriculaire lors de l’injection du gadolinium. L’étendue de la fibrose est corrélée à l’augmentation du volume ventriculaire droit, à l’altération de la fonction ventriculaire droite ainsi qu’à l’altération de la tolérance hémodynamique à l’effort et aux complications rythmiques (Babu-Narayan SV et al. Circulation 2006).
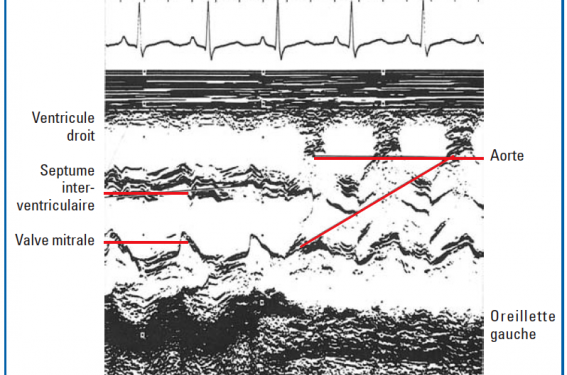
Echocardiogramme en mode TM.
Prise en charge
La prise en charge thérapeutique de ces patients doit être collégiale, faisant intervenir le cardiopédiatre, le rythmologue et le chirurgien cardiaque.
Il convient tout d’abord d’envisager une correction chirurgicale des lésions anatomiques résiduelles, notamment en cas de fuite pulmonaire significative avec dilatation du ventricule droit (volume télédiastolique du ventricule droit > 150 ml/m2).
Le recours aux antiarythmiques ne semble justifié qu’en cas de troubles du rythme ventriculaire soutenus, et avec toutes les précautions requises. Dans ce cas, on aura également facilement recours à l’ablation par radiofréquence, notamment chez les patients porteurs de DAI pour éviter les traitements trop fréquents, souvent mal tolérés. Les circuits de ces tachycardies ventriculaires sont le plus souvent situés dans l’infundibulum pulmonaire et au niveau du patch de CIV.
Quant au DAI, l’indication actuelle est acquise en prévention secondaire (mort subite récupérée, FV, TV mal tolérée). En prévention primaire, nous ne disposons actuellement que de marqueurs ayant une bonne valeur prédictive négative mais une valeur prédictive positive très médiocre. La combinaison des différents marqueurs entre eux semble importante. Par exemple, la combinaison d’une durée de QRS > 180 ms et d’une fraction d’éjection ventriculaire gauche < 40 % a une valeur prédictive positive de 66 % et négative de 93 % (Ghai A et al. JACC 2002).
Un score de risque a donc été développé a posteriori en prévention primaire par Khairy (Khairy P et al. Circulation 2008), basé sur six critères (antécédent de shunt palliatif, tachycardie ventriculaire soutenue inductible, durée des QRS ≥ 180 ms, antécédent de ventriculotomie, tachycardie ventriculaire non soutenue, pression télédiastolique ventriculaire gauche ≥ 12 mmHg). Pour être valide, ce score nécessite une évaluation prospective. À noter que cette étude rapportait un taux de complications élevé (29,8 %), notamment en rapport avec des dysfonctions de sondes. Le taux de chocs inappropriés était également non négligeable (5,8 % par an).
Il apparaît donc licite d’envisager une surveillance systématisée de ces patients, avec une vigilance particulière concernant les risques hémodynamique et rythmique.
Quelle surveillance en pratique ?
Nous proposons :
De façon annuelle, la réalisation :
– d’un électrocardiogramme 12 dérivations,
– d’une échocardiographie transthoracique,
– d’un Holter-ECG de 24 heures.
Vers l’âge de 4-6 ans, selon les capacités de l’enfant : une épreuve d’effort.
Vers l’âge de 10-12 ans, la réalisation :
– d’une nouvelle épreuve d’effort,
– d’une IRM cardiaque, afin d’évaluer les séquelles anatomiques, ainsi que le degré de fibrose myocardique.
Vers l’âge de 14-16 ans, une nouvelle épreuve d’effort.
Décision d’implantation d’un DAI
En prévention secondaire, l’indication est formelle en cas de fibrillation ventriculaire, de tachycardie ventriculaire mal tolérée, ou de mort subite récupérée.
En prévention primaire, on en discutera, notamment lorsqu’au moins deux marqueurs de risque rythmique sont présents parmi les suivants :
– FE < 40 %, fuite pulmonaire résiduelle sévère,
– durée des QRS > 180 ms, fibrose étendue à l’IRM cardiaque,
– tachycardie ventriculaire non soutenue lors du Holter ECG des 24 heures ou de l’épreuve d’effort.
En cas de présence d’un seul marqueur, on pourra s’aider d’autres critères recherchés et moins puissants, avec notamment la durée du BAV complet en période postopératoire (> 3 jours), le type de réparation chirurgicale (présence ou non d’un patch transannulaire), de la SVP démaquillée du fait de sa bonne valeur prédictive négative, des potentiels ventriculaires tardifs.
Enfin, une correction chirurgicale des lésions hémodynamiques résiduelles s’avère indispensable, notamment en cas de fuite pulmonaire significative avec retentissement ventriculaire droit, et doit être le primum movens de la prise en charge de ces patients.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :