Cardiomyopathies
Publié le 14 juin 2005Lecture 5 min
Un ECG normal permet-il d'éliminer une cardiomyopathie hyperthrophique ?
P. CHARRON, hôpital Pitié-Salpêtrière, Paris

Le diagnostic de cardiomyopathie hypertrophique (CMH) est souvent aisé en pratique clinique parce que l’on est face à une forme caricaturale de la maladie et que l’on dispose, avec l’ECG et l’échocardiographie, d’outils remarquablement performants à cet égard. Cependant, dans des situations de plus en plus fréquentes, le clinicien peut éprouver de réelles difficultés pour interpréter les résultats et notamment pour écarter le diagnostic. Il s’agit par exemple de la rédaction d’un certificat d’aptitude au sport chez un consultant sans antécédent personnel ni familial de cardiomyopathie, ou encore d’une enquête cardiologique familiale après le diagnostic d’une CMH avérée chez l’un des membres.
L’ECG garde ici toute sa place, et son interprétation doit être scrupuleuse.
L’ECG typique de CMH
Le tracé typique (figure 1) retrouve l’association à des degrés divers de trois anomalies classiques :
• une anomalie de repolarisation (segment ST et ondes T),
• une hypertrophie ventriculaire gauche électrique,
• des ondes Q de pseudo-nécrose.
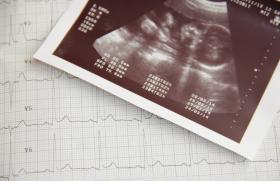
Figure 1. Tracé ECG et image échographique (2D, parasternale gauche grand axe) chez un patient de 28 ans avec forme caricaturale de CMH (épaisseur septale > 30 mm en échographie, présence des trois anomalies majeures sur le tracé ECG).
La fréquence de ces trois anomalies chez des patients ayant une CMH échographique est respectivement d’environ 60–80 %, 45–60 % et 25–35 %. Encore faut-il s’entendre sur la définition électrocardiographique de ces anomalies.
L’anomalie de repolarisation est communément définie par une inversion des ondes T (vecteur électrique en opposition avec celui du QRS) dans au moins deux dérivations adjacentes et en l’absence de bloc de branche.
L’HVG électrique de la CMH chez l’adulte est rarement définie par l’indice de Sokolow mais plutôt par le score de Romhilt et Estes (score performant mais complexe) qui prend en compte l’amplitude R ou S, une hypertrophie de l’oreillette gauche, la durée et la déviation axiale du QRS, la déflexion intrinsécoïde, la repolarisation, score anormal si Ž 4 ou 5 selon les équipes). Chez l’enfant, le voltage (SV1 + RV6) est habituellement utilisé et rapporté à des tables (Davignon ou Garson) en fonction de l’âge exact.
Les ondes Q de pseudo-nécrose sont souvent définies par des ondes Q de durée > 0,04 et une profondeur > 1/3 (ou > 1/4) de l’onde R suivante dans au moins deux dérivations. Tout récemment, la prise en compte chez l’adulte d’une profondeur > 3 mm (critère souvent retenu chez l’enfant) s’est avérée plus performante pour la définition des ondes Q de pseudo-nécrose.
La bonne performance de l’ECG pour dépister une CMH
On retrouve sur l’ECG l’une au moins des anomalies majeures définies plus haut chez environ 85 % des patients ayant une CMH objectivée à l’échographie. Cette bonne sensibilité s’accompagne d’une très bonne spécificité (> 95 % pour les ondes Q et l’HVG, un peu moins pour les anomalies isolées de repolarisation). L’ECG présente donc une excellente valeur diagnostique et s’avère être un examen de dépistage tout à fait performant. La prise en compte d’une anomalie mineure de l’ECG, quelle qu’elle soit, permet d’augmenter la sensibilité, mais alors la spécificité décroît dramatiquement.
Des discordances entre l’ECG et l’échographie
Les études familiales systématiques couplées à une étude génétique ont permis de préciser la valeur diagnostique respective de l’ECG et l’échographie en prenant comme critère de référence le statut génétique dans ces familles. De façon un peu surprenante, l’échographie peut parfois se révéler normale alors que l’ECG montrait des anomalies patentes signant une CMH dans le contexte familial (il s’agit souvent d’ondes Q de pseudo-nécrose chez des adultes jeunes). Ces cas représentent environ 12 % des patients adultes avec ECG anormal dans une étude française et davantage encore dans une étude japonaise récente. À l’inverse, l’ECG peut être en défaut alors que l’échographie retrouve une HVG franche (14 % des cas dans l’étude française).
Ces observations justifient pleinement la réalisation conjointe des deux examens lors d’une enquête cardiologique familiale après le diagnostic d’une CMH avérée chez l’un des membres.
Un ECG normal n’exclut pas une expression ultérieure de la maladie
Lorsqu’il est strictement normal, de même que l’échographie, l’ECG permet évidemment de conclure à l’absence de CMH au moment des examens. Mais lorsqu’il s’agit d’un apparenté à un patient atteint de CMH, cela ne permet pas de conclure à l’absence de risque ultérieur de développement de la maladie. Du fait de l’expression parfois très retardée de la maladie, la normalité du bilan initial ne peut exclure l’hypothèse que le consultant ait hérité de la mutation responsable de la CMH dans sa famille et qu’il développe ultérieurement la maladie. Cette probabilité est loin d’être rare puisque, dans une étude française, la proportion des porteurs de mutation qui expriment l’hypertrophie (ECG ou échographique) est seulement de 55 % avant l’âge de 30 ans, puis de 75 % entre 30 et 50 ans, et elle passe à 95 % après l’âge de 50 ans. La prudence est donc de mise non seulement chez l’adolescent mais aussi chez l’adulte. Cela a conduit divers experts internationaux à préconiser, dans ce contexte précis, de poursuivre une surveillance cardiologique régulière chez les apparentés, à moins que l’étude génétique ait pu trancher quant au statut de l’apparenté.
L’ECG peut détecter des anomalies avant l’HVG échographique
Avant que l’hypertrophie apparaisse manifeste à l’échographie, il est probable que des anomalies mineures permettent de détecter ce stade « préclinique » de la maladie. Le débat reste ouvert quant à la question de savoir quel est l’outil cardiologique le plus performant à cet égard. Le Doppler tissulaire peut parfois aider, mais sa valeur prédictive négative apparaît mauvaise.
Récemment, une équipe japonaise a montré que l’ECG pouvait être utile avec la présence d’ondes Q de pseudo-nécrose chez 27 % des porteurs de mutations sans HVG échographique (figure 2). Chez l’enfant, une étude française avait antérieurement montré que la prise en compte d’une déviation axiale gauche permettait d’augmenter nettement la sensibilité de l’ECG.
La place de l’ECG dans le diagnostic de la cardiomyopathie hypertophique reste donc primordiale.
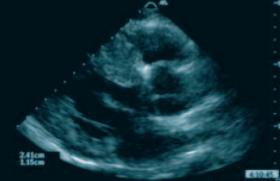
Figure 2. Image échographique (2D, parasternale gauche grand axe) chez un homme de 35 ans, apparenté de patient avec CMH, et porteur de la mutation identifiée dans sa famille dans la chaîne lourde bêta de la myosine. L’échographie ne montre aucune hypertrophie (septum 9 mm), le DTI montre des vélocités myocardiques normales (Ea 19 cm/s) et, pourtant, l’ECG retrouve des ondes Q de pseudo-nécrose (profondeur 5 mm).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :