Complication
Publié le 20 juin 2019Lecture 5 min
Cryoablation au ballon et recours complémentaire à la radiofréquence
Séverine PHILIBERT, Hôpital européen Georges-Pompidou, Paris et Gabriel LAURENT, CHU de Dijon
Les techniques d'ablation de FA sont d’autant plus efficaces qu’elles sont réalisées précocement(1). La déconnexion des veines pulmonaires (VP) est à ce jour la seule recommandation qui fait l’unanimité. La cryoablation (CA) s’est révélée être une technique sûre, efficace et reproductible, uniquement indiquée pour l’isolation des VP(2). On sait cependant que l'évolution naturelle de la FA entraîne une implication plus importante du substrat atrial gauche que des VP.
Résultats de la cryobablation dans la FA paroxystique et persistante
Dans la FA paroxystique, des études observationnelles ont montré des taux de succès de la CA entre 48 % et 85 %, comparables à ceux de la radiofréquence (RF)(3-5). Les études Freeze AF et Fire and Ice ont montré que la CA n’était pas inférieure à la RF à 12 mois(2,6) ce qu’a confirmé la métaanalyse de Chen, avec 65 % de maintien en sinusal en CA ou en RF à 12 mois(7). Il n’y a pas non plus de différence de sécurité entre les deux méthodes(8).
La CA pour la FA persistante est moins documentée car plus récente dans ce cadre. L’étude Cryo4Persistante AF a montré 61 % de succès à 12 mois après une procédure(9).
Les premiers résultats de l’étude canadienne CIRCA-DOSE viennent d’être révélés à EHRA 2019. Il s’agit d’un essai multicentrique randomisé sur 353 patients atteints de FA paroxystique et persistante de moins de 1 an, réfractaire à au moins un anti-arythmique, comparant l’ablation par RF avec la CA par ballon de deuxième génération (CB2). Après une procédure, le maintien en sinusal (aucune arythmie sur le Holter implanté) à 1 an est comparable entre les trois méthodes (RF : 53,9 %, CRYO-4 min : 52,2 %, CRYO-2 min : 51,7 %, p = NS)(10).
Ablation redux par RF après CA : prévalence, facteurs prédictifs et substrat
Plusieurs facteurs de récidive post-ablation ont été identifiés : l’âge, l’ancienneté de la FA, la taille de l’OG, le nombre d’anti-arythmiques, la récidive précoce et les comorbidités (obésité, apnée du sommeil, hypertension et fibrose de l’OG)(11).
Compte tenu de la similarité des résultats après CA ou RF, on ne sait pas si une partie des récidives est liée à la technique (reconnexion de VP car technologie non optimale pour une anatomie particulière de l‘OG), ou dépend de la physiopathologie de l’arythmie (foyers automatiques extraveineux, substrat atrial). Il est important de distinguer la FA paroxystique de la persistante, car il peut s’agir de 2 maladies différentes qui peuvent se présenter sous la même forme, mais évoluer différemment. Dans tous les cas, identifier les facteurs de récidive avant et/ou après CA permettrait d’éviter certaines procédures inutiles et leurs éventuelles complications.
Dans la FA paroxystique
La reconduction veineuse pulmonaire est l’une des principales causes de récidive après CA, par inadéquation entre la morphologie et l’orientation, ou la morphologie des VP et le CB qui a une conception uniforme et rigide (taille 23 ou 28 mm). Compte tenu de la variabilité anatomique des VP, le contact entre le ballon et la VP n’est pas toujours parfait. À l’opposé, l’ablation point par point par radiofréquence n’est pas influencée par les variations anatomiques des VP.
Dans STOP AF Post-Approval Study, après CA de FA paroxystique, 64 % des patients n’ont aucune récidive à 3 ans(12). Cependant, il n’y a pas d’information sur les zones de récidive de conduction chez les 20 % des patients qui ont été repris.
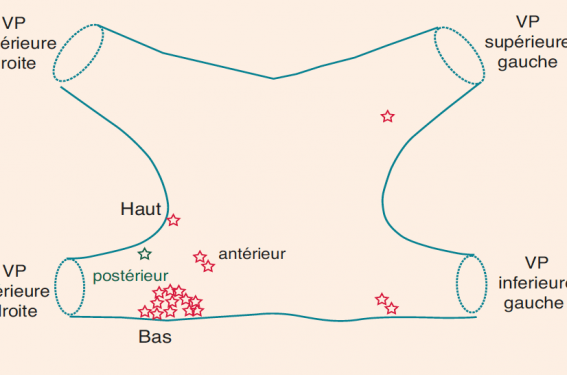
Yokoyama et al ont identifié après CA — chez 105 patients avec FA paroxystique — une reconnexion majoritairement au niveau des VP inférieures droites (figure 1). Près de 60 % des potentiels veineux résiduels se situaient autour de la partie inférieure de cette veine (figure 2), ce qui peut s’expliquer par la difficulté à l’occlure parfaitement du fait d’un ostium très proche de l’abord transeptal. Parmi les facteurs de reconnexion, les auteurs ont identifié un tronc veineux court, une température minimale de congélation du ballon plus élevée et un temps de réchauffement plus court (c’est-à-dire des critères de lésion inefficaces)(13).
Figure 1. Présence de potentiels veineux résiduels après ablation par CB.
Figure 2. Localisation des zones de reconnexion préférentielles des VP après CA.
La qualité des lésions passe par l’optimisation du contact entre le ballon et l’ostium des VP. Quelques astuces ont été décrites par Wilber, notamment la méthode de « pull down » qui consiste à appliquer le froid pendant 30/60 s sur le versant supérieur de la VP, puis à tirer le ballon légèrement vers le bas afin de le plaquer sur le versant inférieur, une partie du ballon étant restée « collée » à la partie supérieure. La même manœuvre vers le haut est également utile (« push up »). Ces techniques sont utiles lorsque l’antre est de forme ovoïde(14) et que l’occlusion complète (angiographie) n’est pas possible. L’isolation durable des VP réduit le risque de récidive de FA. Cependant, certains travaux montrent que 58 % des patients asymptomatiques après ablation présentent toujours une VP connectée(15)…
Dans la FA persistante
Peu d’études ont uniquement inclus des patients en FA persistante traités par CA. Dans une étude de 2013, 30 patients récidivants après CA (22 FA paroxystiques et 8 persistantes), de nouveau ablatés, avaient presque 3 VP/patient reconnectées. Dans la plupart des cas, une ablation segmentaire par radiofréquence a été suffisante(16). Deux ans après la deuxième procédure, le taux de réussite était de 73 %. L’utilisation d’un autre type d’énergie entraîne des lésions de nature différente, pouvant contribuer aux résultats favorables.
L’étude rétrospective de Winkle, incluant des patients en FA paroxystique et persistante longue durée suggère l’utilité du score CAAP-AF (figure 3) pour prédire la récidive après isolation des VP par CB2. Ce score comprend 6 variables simples, un score ≥ 5 prédit la récurrence de FA avec une sensibilité de 64 % et une spécificité de 68 %(17). Dans ce score, on retrouve des critères qui reflètent l’importance du substrat électro-anatomique. La plus récente publication traitant de récidive porte sur le volume de l’oreillette gauche par scanner 3D chez 417 patients avant CA (95 FA persistantes et 322 paroxystiques). Ce volume est un prédicteur indépendant de récidive sur FA persistante, avec 78 % sans récidive si le volume est ≤ 61 ml/m2, contre 22 % si le volume est > 61 ml/m2 (RR 5,771, IC à 95 % de 2,434 à 13,682, P < 0,001)(18).
Les données de la littérature nous indiquent que l’isolation des VP par cryothérapie est aussi efficace et sûre que par radiofréquence dans la FA paroxystique et persistante de moins d’un an. La reconnexion électrique des VP est la principale cause de récidive et survient le plus souvent sur plusieurs veines et de manière localisée autour des ostia. La VP inférieure droite est la plus souvent impliquée dans les récidives du fait de sa position anatomique, source de difficultés à obtenir une occlusion complète avec le ballon. Une procédure redux en radiofréquence semble alors logique compte tenu du caractère segmentaire de la récidive et de la possibilité de foyers extra-veineux, voire d’une participation du substrat dans l’auto entretien de la FA.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


