Mise au point
Publié le 20 juin 2019Lecture 9 min
L’implantation valvulaire mitrale par cathéter
Dominique HIMBERT, Marina URENA, CHU Bichat Claude Bernard, Paris
Alors que le TAVI est depuis longtemps entré dans la pratique courante et s’apprête à devenir le traitement de référence du RAC dégénératif, le développement de l’implantation valvulaire mitrale par cathéter (TMVI) est beaucoup plus lent. Les explications tiennent à la moins bonne identification des candidats à la technique et à la plus grande difficulté du screening et de la procédure elle-même. Le but de cet article est d’apporter quelques informations pratiques sur ces différentes étapes.
Quand penser au TMVI ?
Le TMVI s’adresse aux patients inopérables ou à haut risque chirurgical dans deux populations différentes.
Les patients déjà opérés, ayant une dysfonction de bioprothèse ou d’annuloplastie mitrale
Ils représentent le plus fort contingent des candidats car il s’agit d’une population nombreuse, souvent âgée, pour laquelle une réintervention chirurgicale comporte un risque élevé. D’autre part, le matériel prothétique en place (valve ou anneau) offre une bonne zone d’ancrage et une fixation solide pour une prothèse percutanée déployée par ballon Edwards SAPIEN XT ou 3. Bien que cette option thérapeutique soit utilisée depuis près de 10 ans dans quelques centres, de nombreux autres n’ont toujours pas intégré cette technique et continuent à réopérer d’excellents candidats au TMVI. La reconnaissance officielle de la voie transseptale et de la prothèse SAPIEN 3 pour les interventions valve-in-valve, avec possibilité de proctoring, devrait contribuer à améliorer la diffusion de la technique. Bien qu’il s’agisse de situations assez rares et hors recommandations, le TMVI valve-in-valve ou valve-in-ring peut parfois être proposé à des patients qui ne sont pas à risque chirurgical élevé. C’est le cas de patients jeunes déjà opérés et ne pouvant ou ne souhaitant pas recevoir une prothèse mécanique : par exemple, femmes jeunes désireuses de grossesses ou patients dont le mode de vie est incompatible avec la prise d’un traitement anticoagulant. Dans ces cas, le TMVI permet d’éviter une réintervention chirurgicale en attendant la mise en place ultérieure d’une prothèse mécanique définitive. Ces cas nécessitent une discussion médicochirurgicale et la justification écrite de la décision, dans un centre expert capable de réaliser l’intervention dans les meilleures conditions.
Les patients ayant une valvulopathie mitrale native
Ils sont aujourd’hui moins nombreux que les précédents et se divisent en deux catégories.
• Les valvulopathies mitrales dégénératives associées à une calcification de l’anneau mitral (MAC)
Ces patients sont contre-indiqués pour la chirurgie en raison à la fois de leur profil de risque (âge, athérome, valvulopathies associées, etc.) et de l’obstacle technique et du risque inhérents à la MAC. Il s’agit donc d’interventions compassionnelles sans autre alternative que le traitement médical. Bien que la complexité du screening et de l’intervention soit supérieure et le pronostic plus sévère, la technique et le matériel utilisés sont les mêmes que pour les patients déjà opérés, puisque la MAC peut constituer une zone de fixation solide de la prothèse.
• Les insuffisances mitrales natives, le plus souvent secondaires
Il s’agit de situations très différentes et exceptionnelles, puisque seuls des dispositifs dédiés peuvent être utilisés chez ces patients, dans le cadre d’études précommerciales de faisabilité. Il ne s’agit donc pas d’un soin courant. Seuls quelques centaines de patients dans le monde ont pu être inclus dans ces études, et un très petit nombre en France. Dans tous les cas, il s’agit de patients à haut risque ou contre-indiqués pour la chirurgie, avec des critères d’inclusion/exclusion pouvant varier d’une étude à l’autre.
Comment sélectionner les candidats ?
L’échographie cardiaque transthoracique et transœsophagienne
C’est chronologiquement le premier examen, indispensable pour identifier la nature, le mécanisme et la cause de la valvulopathie ou de la dysfonction de prothèse/anneau, et éliminer une endocardite, une fuite périprothétique, un thrombus valvulaire ou un mismatch, toutes ces situations constituant des contre-indications au TMVI.
Le scanner cardiaque
C’est l’examen clé. Il doit être d’excellente qualité, injecté et comporter des acquisitions sur l’ensemble du cycle cardiaque. Deux points sont essentiels :
• La zone d’ancrage
– Les bioprothèses : l’analyse est simple et porte essentiellement sur leur diamètre interne et leur radio-opacité. La principale limite tient au diamètre : trop petit (< 25 mm), il nécessite l’implantation d’une SAPIEN 3 23 mm et comporte un risque de gradient élevé qui doit être pris en compte ; trop large (> 33 mm), le risque de migration n’est pas compatible avec le TMVI.
Certaines prothèses sont très peu radio-opaques, voire radiotransparentes. Dans ces cas, le positionnement est plus difficile, exclusivement échoguidé.
– Les anneaux : ici l’analyse est plus complexe car il faut prendre en compte leur forme, leur rigidité et leur caractère complet ou non. Les anneaux favorables sont peu ovales ou peuvent se circulariser sous l’effet du gonflage du ballon, donc les moins rigides (semi-flexibles ou flexibles) et complets, sans zone ouverte. Les anneaux ovales, rigides ou incomplets doivent faire rediscuter l’indication du TMVI.
– Les MAC : l’analyse demande une grande expertise car chaque anatomie est unique et l’évaluation et l’interprétation de tous les paramètres sont difficiles : dimensions de l’anneau, volume et distribution des calcifications, extension de cellesci aux feuillets valvulaires, etc. Les implications de cette analyse concernant la taille de la prothèse à utiliser, le risque de déplacement/migration ou de fuite périprothétique restent très observateur dépendantes et leur fiabilité conditionnée par l’expérience.
• La chambre de chasse ventriculaire gauche (CCVG)
Les facteurs favorisant le risque d’obstruction de la CCVG sont bien identifiés et résumés sur la figure 1. Sa prédiction repose sur la simulation dynamique d’une prothèse en place avec calcul de la surface de la néo-CCVG en télésystole. La surface minimale proposée comme acceptable est souvent de 150 mm2, bien que dans notre expérience elle soit plutôt de 100 mm2 (figure 2)(1).
Figure 1. Principaux facteurs favorisant l’obstruction de la CCVG au cours du TMVI (Urena M et al.(2)).
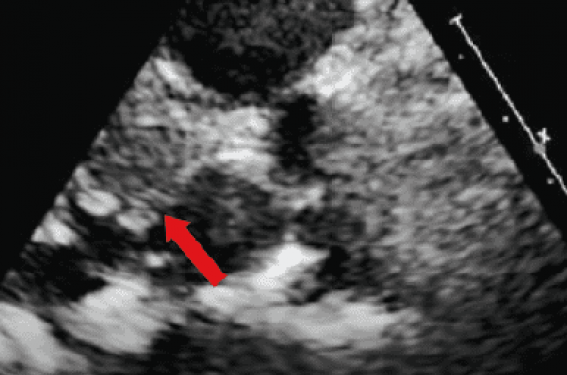
Figure 2. Obstruction de la CCVG et sa prévention par alcoolisation septale (Sayah N et al.(1)).
A : Échographie initiale ; la flèche montre l’épaisseur du bourrelet septal sous-aortique et l’étroitesse de la CCVG. B : Simulation prothèse en place sur le scanner initial ; la flèche montre le contact direct entre la prothèse et le septum, indicateur d’une obstruction de la CCVG. C : Simulation de la néo-CCVG < 100 mm², confirmant le risque d’obstruction sévère de la CCVG. D : Échographie après alcoolisation septale et TMVI ; la flèche montre l’amincissement du septum sous-aortique. E : Scanner postalcoolisation et TMVI : absence de contact entre la prothèse et le septum. F : Néo-CCVG calculée à 160 mm² après alcoolisation septale et TMVI, absence d’obstruction de la CCVG.
Pour les bioprothèses, le risque est très faible du fait de l’absence de grande valve et d’appareil sous-valvulaire antérieur.
Pour les anneaux, il est plus élevé, mais il est maximal pour les MAC, souvent associées à de petits ventricules hyper-trophiques et des CCVG étroites, expliquant la faible proportion de patients éligibles pour un TMVI dans cette population. Cette complication doit impérativement être dépistée et prévenue, car lorsqu’elle survient, elle est létale dans 80 % des cas.
Trois traitements préventifs peuvent être envisagés :
– l’alcoolisation septale, dans le but de diminuer l’épaisseur septale et d’élargir la CCVG (figure 2) ;
– la réalisation d’un TMVI hybride, par voie chirurgicale transatriale sous CEC, avec implantation de la prothèse sous contrôle de la vue après résection de la grande valve et de l’appareil sous-valvulaire (figure 3) ;
– la technique de lacération percutanée de la grande valve (LAMPOON), encore très peu diffusée.
Figure 3. TMVI hybride par voie transatriale avec implantation de la prothèse sous contrôle de la vue.
Comment procéder ?
L’ensemble de la procédure est décrite dans l’article de M. Urena et al.(2) et ses principales étapes résumées dans la figure 4. Le matériel nécessaire est présenté dans le tableau ci-dessous.
Figure 4. Les 10 étapes de la préparation, de la réalisation et de l’évaluation du TMVI par voie transsseptale (Urena M et al.(2)).
Les TMVI pour insuffisance mitrale sur valves natives ont des spécificités techniques liées à chaque dispositif et nous ne traitons ici que des TMVI valve-in-valve, valve-in-ring et valve-in-MAC utilisant les prothèses Edwards SAPIEN XT/3. La voie transapicale ne doit plus être utilisée et nous ne traitons ici que de la voie transseptale. Le guidage ETO est déterminant et impose une anesthésie générale.
En bref :
– La ponction transseptale échoguidée est faite en position postérieure et assez supérieure dans la fosse ovale, pour limiter l’obliquité de la prothèse par rapport à l’anneau mitral.
– Le franchissement de l’orifice mitral est en général très facile si l’on utilise une gaine Agilis™ (St Jude Medical) grande courbure que l’on positionne juste en regard. Il suffit souvent d’avancer un cathéter pigtail pour atteindre l’apex du ventricule gauche. Le guide Safari™ Extra- Small (Boston Scientific) est idéal et offre le meilleur compromis entre facilité d’installation, sécurité et support.
– La dilatation du septum est une étape essentielle car elle peut entraîner un échec de franchissement ou une déchirure septale si elle est insuffisante. Un ballon de 12 mm est en général suffisant, mais l’évaluation ETO de la taille de l’orifice créé et de la présence d’un shunt interatrial est cruciale.
– Le franchissement du septum par la prothèse et l’avancée vers l’orifice mitral sont délicats et nécessitent une bonne combinaison entre flexion et orientation du cathéter. En cas de résistance, la solution consiste à revenir en arrière et recommencer la manoeuvre en modifiant cette combinaison.
– Le positionnement de la prothèse est assez simple pour les valve-in-valve car l’armature offre des repères fiables, mais variables d’une prothèse à l’autre. Il est plus difficile pour les valve-in-ring, surtout pour les anneaux incurvés, car la zone d’ancrage permettant leur couverture par le manchon de la SAPIEN sur toute leur circonférence est étroite et le risque de fuite périprothétique plus important. Comme pour les autres étapes, la difficulté est maximale pour les MAC car les conditions anatomiques diffèrent d’un patient à l’autre et tout positionnement imparfait peut être sanctionné par une migration atriale de la prothèse, une fuite sévère ou une obstruction de la CCVG.
– Le déploiement de la prothèse se fait dans tous les cas sous contrôle fluoroscopique et ETO (figure 5), par un gonflage lent du ballon sous pacing ventriculaire rapide, permettant si nécessaire d’ajuster la position finale.
– L’évaluation échographique immédiate est cruciale et porte sur : la position de la prothèse, la présence/volume d’une fuite intra/périprothétique, la mobilité des feuillets, le gradient transprothétique, la présence/sévérité d’une obstruction de la CCVG, le péricarde, la présence/volume/direction d’un shunt interatrial après retrait du matériel.
Figure 5. Déploiement de la prothèse :
A : Aspect fluoroscopique du déploiement dans une prothèse Mosaic™ (Medtronic). B : guidage du déploiement par ETO.
Comment traiter et suivre un patient après TMVI ?
Sur des bases empiriques, le traitement antithrombotique préconisé repose sur l’association d’aspirine et d’antivitamines K pendant au moins 3 mois, au décours desquels peut être discuté l’arrêt des antivitamines K en l’absence d’autre indication à les poursuivre au long cours.
La surveillance doit être étroite compte tenu de l’absence de données sur l’évolution à long terme de ces patients. Il est souhaitable de faire un bilan paraclinique exhaustif comportant ETT, ETO et scanner avant la sortie (figure 6), qui servira de référence pour l’avenir. Ultérieurement, ce bilan peut être répété annuellement, ou en fonction des données cliniques et de l’ETT, pour dépister thrombose, déplacement, fuite intra/péri, dégénérescence de prothèse et les traiter de façon adaptée.
Figure 6. Images scanner post-TMVI : A : Valve-in-valve ; B : Valve-in-ring ; C : Valve-in-MAC
Conclusion
Le TMVI transseptal est aujourd’hui une alternative intéressante, peu invasive, à une réintervention mitrale chirurgicale à haut risque pour de nombreux patients. Mais il est sous-utilisé et nécessiterait d’être plus largement diffusé.
Le TMVI sur valve native non calcifiée reste dans le domaine de l’évaluation clinique pré-commerciale mais représente pour l’avenir une nouvelle grande avancée dans le traitement percutané des valvulopathies.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


