Mise au point
Publié le 30 nov 2011Lecture 9 min
Les bioprothèses aortiques implantées par voie percutanée
A. TIROUVANZIAM, Hôpital Guillaume et René Laennec, CHU Nord, Nantes
Le rétrécissement aortique dégénératif représente la cause la plus fréquente de valvulopathie avec une prévalence de 5 % chez le patient âgé de plus de 75 ans.
Le pronostic spontané reste sévère dès l’apparition des symptômes avec une médiane de survie de 50 % à 2 ans.
Le traitement de référence reste la chirurgie de remplacement valvulaire aortique dont l’efficacité a été prouvée à long terme.
Néanmoins, près de 30 % des patients ne peuvent bénéficier d’une chirurgie conventionnelle en raison de contre-indication (s) formelle (s) et/ou d’un risque opératoire jugé trop élevé en raison des comorbidités associées.
L’implantation percutanée de bioprothèse aortique ou TAVI (trans-aortic valve implantation) représente une alternative moins invasive destinée aux patients pour qui une chirurgie conventionnelle est contre-indiquée ou jugée à haut risque.
Depuis la première implantation chez l’homme effectuée par Alain Cribier à Rouen en 2002, plus de 50 000 TAVI ont été réalisés à travers le monde.
Plus de 350 centres en Europe, dont 33 en France habilités par la Haute Autorité de Santé (HAS), pratiquent cette intervention. Outre-Atlantique, la FDA (Food and Drug Administration) vient désormais de l’autoriser sur le continent nord-américain.
Deux prothèses sont actuellement disponibles : Edwards Sapiens XT (Edwards Life Science Irvine, États-Unis) et CoreValve (Medtronic Inc, Minneapolis, États-Unis).
L’étude PARTNER
PARTNER (Placement of AoRtic TraNs-cathetER Valve) a évalué l’intérêt du TAVI chez les patients présentant un rétrécissement aortique serré et symptomatique et ayant une contre-indication à la chirurgie, comparativement au traitement médical et chez ceux considérés à haut risque chirurgical en comparaison du remplacement valvulaire conventionnel. Il s’agit d’une étude multicentrique randomisée en deux cohortes.
La cohorte B(1)
Elle a inclus 358 patients parmi lesquels 179 étaient randomisés dans le groupe traitement médical (autorisant la valvuloplastie aortique au ballon seul) et 179 dans le groupe TAVI par voie transfémorale.
À un an le critère primaire, décès toutes causes confondues était diminué de manière significative dans le groupe TAVI, comparativement au groupe traité médicalement (20,5 % vs 44,6 %, hazard ratio : 0,55 ; IC 95 % : 0,4-0,74 ; p < 0,01) (figure 1).
Il y avait de plus une amélioration significative des symptômes, comme l’atteste le test de marche de 6 minutes dans le bras TAVI.
Néanmoins, on note davantage de complications neurologiques dans le groupe TAVI (6,7 % vs 1,7 % ; p = 0,03) et d’AVC majeurs (5 % vss 1,1 % ; p = 0,06). Le taux d’implantation de pacemaker était similaire dans les deux groupes.
Dans le groupe TAVI 6,3 % des patients ont bénéficié de l’implantation de multiples valves avec 2,3 % de procédures dites « valve in valve ».
Figure 1. Etude PARTNER (cohorte B) : mortalité cardiovasculaire.
La cohorte A
La cohorte A de l’étude PARTNER(2) était une étude de non-infériorité composée de 699 patients considérés comme à haut risque chirurgical.
Les patients étaient randomisés en deux groupes, le groupe TAVI par voie fémorale ou apicale (respectivement 244 et 104 patients), en comparaison à un groupe traité par voie chirurgicale classique (n = 354).
Les patients présentaient dans les deux groupes un score STS (Society of Thoracic Surgeons) supérieur à 10 % avec des caractéristiques similaires. Le taux de mortalité à 1 an était de 24,2 % dans le groupe TAVI et de 26,8 % dans le groupe chirurgical, cette différence de 2,6 % correspondant au critère préspécifié de non-infériorité (figure 2). L’objectif de l’étude était donc atteint.
À l’instar de la cohorte B, les complications neurologiques étaient plus fréquentes dans le groupe TAVI (5,5 % vs 2,4 % ; p = 0,04) à 30 jours.
À 1 an, on note également plus de complications vasculaires dans le groupe TAVI (18 % vs 4,8 % ; p < 0,001), par contre le taux de complications hémorragiques sévères était supérieur dans le groupe chirurgical (4,7 % vs 25,7 % ; p < 0,001).
Les auteurs notaient par ailleurs une réduction significative de la durée de séjour en unité de soins intensifs (3 vs 5 jours ; p < 0,001), ainsi que de la durée d’hospitalisation (8 vs 12 jours ; p < 0,001) dans le groupe TAVI.
L’amélioration des symptômes (classe NYHA et test de marche de 6 min) est comparable après 1 an dans les deux groupes.
Les deux bras de PARTNER ont été effectués avec la première génération de la valve Edwards Sapiens 24 F.
Figure 2. Etude PARTNER (cohorte A) : mortalité toutes causes après 1 an.
PARTNER 2
Une seconde étude prospective de non-infériorité, randomisée multicentrique, l’étude PARTNER 2, est en cours de réalisation avec pour objectif de comparer l’ancienne et les nouvelles générations des valves Edwards (Edwards Sapiens XT et 18 F Novaflex System).
Après les résultats spectaculaires de la cohorte B de l’étude PARTNER, la FDA a approuvé et autorisé la procédure de TAVI pour les patients chez qui le remplacement valvulaire aortique est contre-indiqué.
L’ouverture de plus de 450 centres habilités à la technique est en cours de réalisation aux États-Unis.
Le registre FRANCE 2
FRANCE 2 (French Aortic National CoreValve and Edwards) a été présenté en août 2011 à la Société européenne de cardiologie(3) au nom des 33 centres français habilités à implanter les bioprothèses par voie percutanée. Ce registre, qui a démarré en mars 2010 et a inclus à ce jour 3 075 patients, est le registre prospectif incluant à la fois la valve Edwards et la CoreValve, le plus large au monde.
L’analyse en cours évalue 3 075 patients et comprend le suivi de 2 419 patients sur une période de 6 mois ayant bénéficié de l’implantation d’une valve Edwards Sapiens (68 %) et d’une CoreValve Medtronic (32 %). La majorité des prothèses ont été implantées par voie transfémorale, 19 % l’ont été par voie transapicale et 5 % par voie sous-clavière.
Les résultats de la pratique française
Avec une moyenne d’âge de 82,5 ± 7 ans, on notait 25 % de diabétiques, 22 % de patients porteurs d’une artériopathie des membres inférieurs et 48 % des patients ayant une coronaropathie associée.
L’EuroScore moyen était de 22,3 % ; il était identique dans les deux groupes et le score STS était de 14,7.
Soixante-quinze pour cent des patients étaient en classe NYHA 3 ou 4 ; 71,6 % des procédures ont été effectuées sous anesthésie générale dans le cathlab avec une proportion croissante de procédures effectuées en salle hybride (15,7 %).
On a noté un taux de succès d’implantation de 97,1 %.
L’amélioration hémodynamique était constante avec une surface passant de 0,67 cm2 en moyenne à plus de 1,7 cm2, le gradient moyen passant de 48 mmHg à 10 mmHg, ces données persistant à un an.
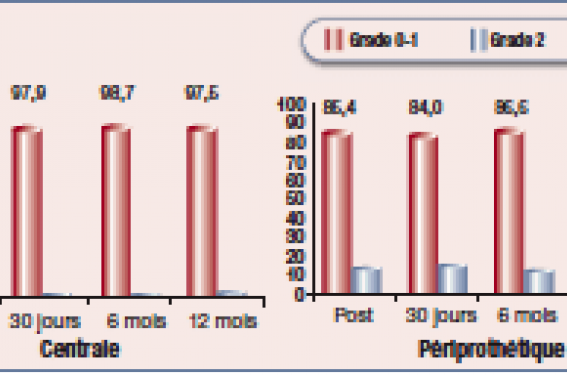
Il y a eu une fuite périprothétique grade 0 ou 1 chez 85,4 % des patients et 90,4 % des patients ont une fuite de grade 0 ou 1 après 1 an (figure 3).
Enfin, la fraction d’éjection s’est améliorée de 53,2 ± 14 % à 57,5 % à 6 mois et 50,3 % à 1 an.
On note un taux de mortalité de 9,9 % à 30 jours et de 17,2 % à 6 mois, avec un taux identique pour les deux types de valves.
Le taux de mortalité par type de valve et par voie d’abord n’était pas différent de manière significative à 6 mois dans les quatre groupes avec néanmoins une tendance à un taux de décès plus élevé observé dans le groupe transapical (transfémoral Edwards = 13,4 %, transfémoral CoreValve = 14,4 %, transapical Edwards = 19,4 %, sous-clavière CoreValve = 18,7 %).
Les complications majeures à 30 jours, selon les critères du VARC (Valve Academy Research Consortium) ne montrent pas de différence significative entre les deux types de bioprothèses, si ce n’est un taux d’implantation de pacemaker supérieur dans le groupe CoreValve (20 % vs 8,5 %) (tableau).
En analyse multivariée, seuls l’EuroScore et la classe fonctionnelle NYHA étaient prédicteurs de mortalité à 30 jours et 6 mois.
Figure 3. Registre FRANCE 2 : régurgitation aortique (grades).
L’aspect médico économique
Une étude de coût a été menée à partir des données de ce registre. Plusieurs enseignements ont pu être tirés :
– les coûts de l’acte et du séjour par patient sont estimés respectivement à 22 917 € (dont 85 % pour le prix de la valve) et 32 018 € ;
– le coût moyen de l’acte est supérieur en cas d’utilisation de la valve Edwards par rapport à la CoreValve ;
– le coût moyen de séjour hospitalier est supérieur en cas d’utilisation d’une bioprothèse Edwards par voie transapicale par rapport à une CoreValve ;
– Enfin, on ne met pas en évidence de différence significative quelle que soit la valve implantée par voie transfémorale.
Les recommandations de la HAS
Après réunion avec un comité multidisciplinaire d’experts, la HAS a statué sur les indications retenues du TAVI en 2011. Elles sont parues en novembre 2011.
À la lumière actuelle des données de la littérature, ne peuvent bénéficier du TAVI que les patients présentant une sténose aortique sévère symptomatique contre-indiquée à la chirurgie. Cette contre-indication chirurgicale ainsi que l’indication retenue de procédure de TAVI doivent être discutées lors d’une réunion multidisciplinaire prenant en compte l’EuroScore logistique supérieur à 20 % ou le STS supérieur à 10 %, ainsi que les comorbidités du patient. Cette réunion doit être assortie de la rédaction d’un compte rendu annexé au dossier médical du patient.
La HAS a par ailleurs estimé que la voie transfémorale devait être privilégiée compte tenu du caractère mini invasif et du plus grand recul de cette voie d’abord.
Le refus de la chirurgie de remplacement valvulaire ne constitue pas une indication au TAVI.
Les patients ayant une espérance de vie inférieure à 1 an ne sont pas éligibles à la technique.
La sélection des patients retenus pour le TAVI doit être réalisée de manière collégiale et multidisciplinaire autour d’une équipe regroupant un cardiologue interventionnel, un chirurgien cardiaque, un anes-thésiste réanimateur avec la présence fortement recommandée d’un gériatre.
En ce qui concerne la formation, un opérateur pourra être habilité à pratiquer le TAVI selon les conditions suivantes :
• appartenir à un centre effectuant plus de 200 remplacements valvulaires aortiques par an ;
• avoir déjà l’expérience de la valvuloplastie au ballonnet et/ou de la technique d’implantation d’endoprothèse aortique thoracique couverte et/ou d’ECMO (extracorporeal membrane Oxygenation) percutanée ;
• avoir l’expérience du franchissement d’un ré-trécissement aortique calcifié et serré ;
• et enfin avoir une formation pratique par compagnonnage à cette technique.
La composition de l’équipe médicale durant l’intervention doit comprendre un anesthésiste réanimateur formé en chirurgie cardiaque et deux opérateurs qualifiés dont un au moins en cardiologie interventionnelle pour la voie transfémorale et au moins un chirurgien cardiovasculaire et thoracique pour la voie transapicale.
Enfin, en ce qui concerne l’environnement technique, les prérequis retenus pour l’implantation et la réalisation d’un TAVI sont des salles de cardiologie interventionnelle et de chirurgie cardiaque regroupées sur le même site et dans le même bâtiment en cas de nécessité de conversion en urgence, la salle idéale étant une salle hybride caractérisée par une ECMO en salle, une qualité d’imagerie optimale, un site d’anesthésie et un traitement de l’air conforme à un bloc opératoire.
La réalisation d’un TAVI par voie transapicale est possible en salle de cathétérisme dès lors que les conditions précitées sont remplies.
Enfin, le groupe d’experts a considéré trois axes d’évolution dans le futur :
• L’extension des indications à des patients à risque moins élevé.
• La technique dite de « valve in valve » actuellement contre-indiquée et hors marquage CE, celle-ci regroupant deux situations cliniques distinctes :
– la première effectuée dans une situation dite de sauvetage (fuite massive, embolisation, etc.) ;
– la seconde étant l’implantation dans une bioprothèse préexistante dégénérée.
Ces deux dernières situations font toujours l’objet d’une contre-indication au marquage CE en l’absence de données probantes de la littérature.
Conclusion
Les données du registre FRANCE 2 font état à ce jour d’un taux d’implantation de plus de 3 000 patients jusqu’en août 2011. Selon les données du PMSI et la publication de l’EuroHeart Survey, plus de 31 % des patients symptomatiques sont récusés pour un remplacement valvulaire aortique conventionnel, ce qui permet de cibler près de 5 175 patients potentiellement éligibles par année en France pour une procédure de TAVI.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


