Polémique
Publié le 29 juin 2021Lecture 15 min
Les syndromes coronariens aigus sans sus-décalage ST - Une cuvée décevante ?
Jean-Pierre MONASSIER, ancien Président du GACI ; Hôpital Albert Schweitzer, Colmar
En médecine, la vérité est sans cesse remise en cause par l’évolution de la science dont on sait qu’elle n’est pas indemne d’erreurs. Les recommandations des sociétés savantes ont pour objectif de préciser la vérité du moment. Cette louable ambition est ancienne. Ainsi, le Royal College of Physicians a été fondé à Londres en 1518 par le roi Henri VIII pour répondre aux critiques qui souhaitaient des Guidelines pour homogénéiser la pratique médicale.
Depuis environ 30 ans, de nombreuses sociétés et collèges d’experts se sont attelés à la tâche. La Société française de cardiologie (SFC) a décidé au cours des années 1990 de faire siennes les recommandations européennes.
Mais l’Europe est loin d’être homogène dans ses structures et sa pensée, et il faut en tenir compte en lisant les différents textes qui nous sont régulièrement proposés (et non pas imposés). Tout médecin et notamment ceux confrontés à l’urgence coronarienne – urge tistes, cardiologues interventionnels et chirurgiens – sont disposés à adapter leurs pratiques aux données les plus récentes de la connaissance en matière notamment de pathologie coronaire.
Ils gardent cependant le droit de débattre voire de critiquer !
Certes « la critique est aisée alors que l’art est difficile » et c’est avec admiration pour l’immense travail accompli par les auteurs que des sujets de discussion seront mis en évidence ici. On ne peut que se réjouir que le texte récent concernant la prise en charge des syndromes coronariens aigus (SCA) non-ST+ ait pour premier auteur signataire un collègue français dont les travaux personnels sont reconnus et que d’autres, de plus en plus nombreux, y aient largement participé. Cela n’est qu’une confirmation de plus que la recherche cardiologique de notre pays est largement reconnue contrairement à ce que quelques illuminés ont pu clamer précédemment. On aurait toutefois pu trouver la place de rappeler à quel point les auteurs français sont à l’origine de la révolution antiplaquettaire après implantation de stents (Paul Barragan, Marie-Claude Morice et Jacques Benveniste) au cours des années 1990.
Il n’est pas interdit de se poser la question de savoir si nous sommes face à la meilleure production du groupe de travail de l’ESC(1) – les plus grands compositeurs ont parfois produit des œuvres moins enthousiasmantes que les autres, même Mozart.
La recherche de l’exhaustivité nuit évidemment à la clarté du propos et il faut de nombreuses relectures pour avoir l’impression de comprendre tous les messages des auteurs. Pourtant, et ce devrait être le cas pour un texte qui entend agir sur la pratique quotidienne : « Ce qui se conçoit bien s’énonce clairement et les mots pour le dire arrivent aisément » : le groupe de travail de l’ESC a à l’évidence rencontré des obstacles pour espérer répondre à cette affirmation de Boileau.
Remarques préalables
Le texte qui suit ne se veut pas polémique, car une telle attitude manquerait de modestie. Un débat amical est néanmoins nécessaire.
Le défi était certes difficile et semé d’embuches mais je n’ose imaginer la situation d’un interne ou d’un chef de clinique recevant un patient SCA ST- et sortant ses fiches soigneusement rédigées avec l’aide de ses seniors, et résumant « les dernières Recos » qu’il faut bien entendu appliquer impérativement.
Le long chapitre initial sur la démarche diagnostique et l’évaluation du niveau de gravité des patients aura certainement été utile à beaucoup de nostalgiques des questions d’internat. On aurait pu simplifier des évidences alors que le traitement antithrombotique dont il sera essentiellement question ici a été rapidement résumé en conseillant de se rapporter aux recommandations de 2017(2). On aurait aimé que la réalisation d’une échocardiographie soit recommandée car connaître la fraction d’éjection est une donnée utile pour conduire l’angioplastie.
Conseiller une revascularisation complète au cours d’un SCA ST- (contrairement au SCA ST+ en urgence hémodynamique), est une coquetterie dangereuse (source de complications de l’angioplastie des artères non coupables, d’insuffisance rénale et d’une irradiation excessive malgré les systèmes perfectionnés de protection... sans citer la fatigue des équipes) ! Ce dernier aspect devrait être une « Reco IA»!
Le lien entre le texte et les tableaux établissant les « Recommandations » n’est pas toujours évident et comporte parfois des contradictions.
On aurait pu faire une place plus importante aux diabétiques (et non pas seulement en conseillant d’éviter de les mettre en hypoglycémie, ce que, avouons-le, nous savions déjà. La prévalence du diabète de type 2 atteint désormais près de 30 %.
Cela aurait été intéressant de savoir pourquoi le fossé se creuse ainsi avec les équipes chirurgicales. Les patients sont plus âgés, polyartériels et pluritronculaires : dans ce contexte, la meilleure garantie contre le risque hémorragique sous antithrombotiques au long cours reste une revascularisation chirurgicale avec une ou deux mammaires internes perméables. Le faible nombre d’indications de pontage est en lien direct avec les morts ultérieures par hémorragie.
Je vous propose d’entrer dans le vif du sujet : comment résoudre la quadrature du cercle qui consiste à tenter d’éviter à la fois l’hémorragie et la thrombose, deux objectifs antagonistes ?
Que nous en disent clairement (?) les recommandations ?
1. La phase préhospitalière
Elle a été oubliée ! Sur quelles bases pourrons-nous discuter avec nos collègues du Samu qui, devant un accident coronarien aigu avec ECG modifié souhaitent mettre en œuvre une stratégie unique ? L’utilisation d’une dose de charge d’un anti-P2Y12 est reconnue dans le SCA ST+ car elle prépare à l’angioplastie primaire qui va suivre. Son efficacité a toutefois été remise en cause par l’étude ACCOAST(3) et soutenue par le registre européen MULTIPRAC(4) qui a montré l’utilité du prasugrel face au clopidogrel. Mais l’étude n’est pas randomisée. Nous verrons plus loin que dans le SCA ST- cette stratégie antiplaquettaire d’urgence pourrait être plutôt un obstacle pour le cardiologue de l’USIC et le cardiologue interventionnel. Elle est contraire aux données les plus récentes (en séparant bien SCA ST+ et ST-).
Il faut établir un dialogue avec nos consœurs et confrères présents dans l’ambulance et proposer une attitude plus individualisée en fonction de la permanence ou non de la douleur et des informations électrocardiographiques.
2. La phase hospitalière précoronarographie
Le diagnostic étant affirmé, les pathologies et comorbidités associées étant évaluées (diabète, insuffisance rénale, maladie polyartérielle, troubles du rythme – fibrillation auriculaire, prothèse valvulaire), nous ne pouvons qu’approuver le niveau IA de l’héparine (HNF ou HBPM) dont les avantages sont nombreux : efficacité biologique facile à vérifier et entrant dans la routine de toute USIC. Elle garantit l’absence de sur-risque hémorragique en cas de pontage urgent et sera poursuivie en salle de cathlab (voir En salle). On comprend moins bien le retour obstiné de la bivalirudine et du fondaparinux qui s’accrochent sans apporter de données incontestables. Ces évocations donnent au lecteur l’impression que comme au cours des grands sommets politiques européens, il est indispensable de faire plaisir à tout le monde. Les antiplaquettaires et notamment les anti-P2Y12 n’apportent rien à ce moment de l’évolution du SCA ST- voire augmentent le risque hémorragique immédiat au décours d’une stratégie invasive.
La place de l’aspirine dès ce stade n’est pas clairement précisée. Pourquoi gênerait-elle ? C’est effectivement le cas lorsqu’une intervention chirurgicale de pontage en urgence est décidée. Si une complication hémorragique postangioplastie se produit, l’aspirine rend plus ardue la tâche de l’opérateur car elle inhibe massivement les plaquettes et le seul antidote est la transfusion massive de plaquettes : dommage !
3. En salle
Tous les cardiologues interventionnels et les anesthésistes sont en phase avec les « Recos » : il faut poursuivre l’héparine et exiger un ACT ≥ 250 s et y ajouter une dose de charge IV d’aspirine dès que l’anatomie coronaire est connue et qu’une angioplastie immédiate est décidée. La discussion sur le choix entre les voies radiale et fémorale présente un aspect moyenâgeux. Pourquoi ne pas dire « officiellement » (même si certains discutent encore ce point) que l’abord fémoral ne doit plus être utilisé qu’en recours et qu’il sera plus hémorragipare ?
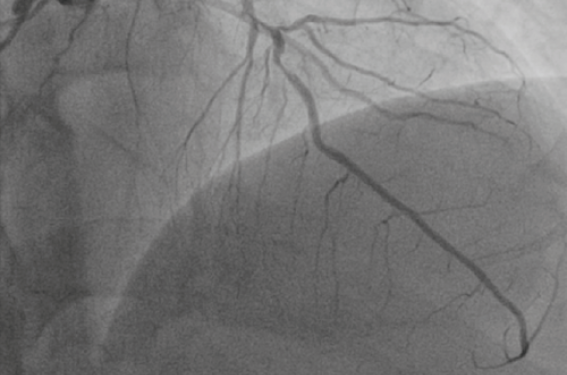
Lorsque l’opérateur a objectivé la (ou les) lésion(s) coupable(s) (figure 1) et le nombre de vaisseaux sténosés, il prend la décision de traiter la sténose responsable du SCA ( j’ai donné plus haut mon avis sur la revascularisation complète en un temps). Dans 10 % au moins des cas, le score Syntax est supérieur à 33, cut-off pour la chirurgie. Certes, dans cette étude, peu de SCA ont été inclus.
Figure 1. Patient de 64 ans : SCA ST- troponine +, sténose trifocale de l’IVA.
Il faudra alors distinguer la lésion menaçante à très court terme et la traiter avec un stent. Pour d’autres sténoses – je pense à un SCA ST- sur une coronaire droite mais en présence d’une IVA proximale peu « sympathique » avec ou sans CX ou marginale volumineuse –, qui peuvent attendre 24 à 48 heures, il faut reprendre l’ensemble du dossier clinique et savoir céder la place au chirurgien sans inonder le patient d’antiplaquettaires, et ainsi lui garantir l’absence d’ennuis dus aux protocoles antithrombotiques.
Si un thrombus volumineux ou fragile et emboligène est présent, il reste une place pour la thrombectomie, éliminée de ces recommandations, et l’utilisation in situ des anti-GPIIa-IIIb. Le cangrélor, biologiquement intéressant, a fait le forcing et a fini par convaincre les rédacteurs(5). La Haute Autorité de Santé française, tant décriée, ne lui accorde aucune « amélioration du service rendu ». C’est alors que le retour d’expérience de la part des labos interventionnels serait utile.
4. Première année après l'angioplastie
La lésion coupable est traitée (figure 2). Ce patient sera à plus haut risque ischémique et pourra justifier d’un traitement antithrombotique prolongé (voir plus loin). Cette affirmation du lien entre longueur de stenting et risque tardif est discutée, y compris par les collègues qui réalisent des désobstructions d’occlusions chroniques avec des longueurs considérables de stents, mais ce ne sont pas des SCA. Voilà un beau sujet de controverse !
Figure 2. Couverture par un stent de 48 mm complétée par un second de 18 mm en raison d’un trait de dissection distale.
La longueur du ou des stents implanté(s) a-t-elle un effet mécanique et biologique sur l’avenir du patient ? Certains considèrent qu’au-delà de 30 mm on accroît les risques de thrombose et de resténose. D’autres s’accordent sur une longueur totale maximale de 60 mm (tableau 11 page 1 316, à mon avis ce chiffre est excessif). Sauf traitement de complications, une telle métallisation coronaire met-elle le patient en sécurité à long terme ? Quels sont, avec le matériel dont nous disposons aujourd’hui pour traiter les SCA, les taux respectifs de resténoses et de thromboses, y compris tardives, au-delà de 30 mm de stents et que dire des artères de 2,5 mm de diamètre ?
Les recommandations ont le tort de ne pas soulever ce sujet plus nettement. Elles pourraient avouer, par exemple, que ces chiffres n’existent pas actuellement sauf à partir de données anciennes.
Par ailleurs, ne faut-il pas affirmer haut et fort que seuls les stents DES de dernière génération ont une place ?
Un double traitement antiplaquettaire avec prasugrel ou ticagrélor et aspirine pendant 1 an est la règle acceptée par tous. Des durées plus courtes de 6 mois ne semblent pas apporter de bénéfice chez les patients qui n’exigent pas par ailleurs un traitement anticoagulant oral (voir plus loin). La préférence pour le prasugrel affichée après ISAR-REACT 5 doit faire l’objet de débats(6,7). Cette étude est discutée, notamment sur le plan méthodologique(7) et quant à sa réalisation pratique sur le terrain. Elle donnera certainement lieu à d’autres commentaires qui nous éclaireront.
Il n’est donc pas temps, là encore, d’abandonner l’un pour l’autre mais d’évaluer les deux molécules dans chaque centre et de réunir nos données de suivi au plan national. Soyons en phase : « je ne dis pas qu’il faut fermer les frontières et ne pas croire aux résultats des autres travaux européens, mais au contraire qu’il est préférable de pouvoir faire franchir ces mêmes frontières à nos propres données ». Encore faut-il en disposer ! Le registre suédois SCAAR en est un exemple.
Dans le tableau réunissant les recommandations concernant la première année, les lignes 6 et 8 (page 1 314) devraient être momentanément supprimées car non conformes aux données de la science.
Pendant cette période, tout paraît donc assez simple.
Toutefois, le choix thérapeutique se complique quand le patient est en fibrillation auriculaire, dont l’incidence est notoirement sous-estimée : il faut cumuler les FA permanentes, paroxystiques voire intermittentes mais de longue durée auxquelles il faut ajouter les patients ayant été soumis à une ablation, technique qui exige une anticoagulation prolongée postopératoire. Se joignent les cas sous traitement anticoagulant oral : présence d’une prothèse valvulaire voire d’une maladie thromboembolique veineuse sévère. Le sujet est majeur et « évacué » en 4 pages sur 47 ! Depuis les recommandations de 2017 d’autres données sont pourtant disponibles.
Les auteurs ont essayé de réunir des informations disparates et des essais dans lesquels les SCA dilatés ne sont pas toujours majoritaires. Ils ont néanmoins eu le mérite de proposer la liste complète des 6 études randomisées et de leurs protocoles (tableau 13, page 1 319)(1,10-12). Ces derniers ont l’inconvénient d’être très hétérogènes. RE-DUAL(9,10) compare la bithérapie incluant dabigatran 110 ou 150 mg/j et Aspirine à la triple association AVK + clopidogrel ou ticagrelor (12 % des cas) + Aspirine en différenciant clairement les SCA revascularisés avec stent et les coronaropathies stables. La posologie de 110 mg est très significativement moins hémorragipare que la trithérapie (tableau 1). Les événements ischémiques sont comparables quelle que soit la stratégie.
Les anticoagulants oraux (OAC) doivent certes remplacer les AVK, comme cela est dit, avec d’inutiles précautions de langage, et chaque équipe peut choisir « sa » molécule anticoagulante en ayant relu les résultats des essais cliniques. On aboutit à une triple thérapie courte voire très courte puis à une bithérapie avec un nouvel anticoagulant (NOAC) dûment testé(1,2,8-12) et poursuivie jusqu’à 1 an. En se reportant comme le suggèrent les auteurs (pour ce thème comme pour d’autres) aux recommandations de 2017(2), on ne peut proposer aux patients que des stratégies « les moins mauvaises » : le nombre d’hémorragies reste ainsi élevé (environ 15 % à 1 an, chiffre variable en fonction du niveau de risque initial).
Au long cours, la proposition d’utiliser le rivaroxaban (15 ou 10 mg) doit être considérée comme une voie de recherche et non pas comme une recommandation(1). Toutefois, une première belle étude, AFIRE(13), aborde cette problèmatique (rivaroxaban seul à 15 mg si fonction rénale normale vs rivaroxaban + clopidogrel ou aspirine). Le nombre d’hémorragies (totales et graves) est inférieur avec la monothérapie... À suivre.
Cette thématique à propos des patients porteurs d’une des trois formes d’arythmie cardiaque par fibrillation auriculaire (ACFA) comme ceux sous anticoagulant pour une autre indication et traités par angioplastie avec stent au cours d’un SCA est loin d’avoir atteint un niveau de certitude définitive. Elle reste très débattue(10,13). En pratique quotidienne, on peut proposer dans nos cath-labs, le traitement des lésions coupables et d’éviter de trop longs stentings(14).
Ces patients doivent être ensuite suivis cliniquement de façon rapprochée. Si l’évolution est favorable, une revascularisation complémentaire différée pourra être effectuée avec plus de sécurité.
Ce sujet important doit être l’objet d’informations auprès de nos collègues cardiologues et géné-alistes libéraux ainsi qu’avec les médecins d’autres services hospitaliers qui gèrent « nos » complications !
Voilà une autre recommandation essentielle et qui ne nécessite pas d’étude randomisée !
5. Traitement prolongé
Pourquoi se compliquer la vie et proposer une « antiagrégation plaquettaire lourde » et prolongée jusqu’à 2 ou 3 ans lorsque la première année s’est déroulée sans incident (tableau 11, page 1 316) ? J’ai défloré le sujet plus haut pour être d’emblée complet chez les patients en ACFA... Mais qu’en est-il des autres ?
Il ne s’agit plus de prévenir les thromboses de DES de dernière génération, événements dont la survenue devient exceptionnelle au-delà d’un an, mais de faire face à d’autres complications de l’athérome : patients poly-artériels, antécédents anciens d’infarctus myocardique, diabétiques (tableau 11, page 1 316).
Que disent les experts à propos de la prolongation de la DAPT après 12 mois ?
Quels sont les résultats de la double antiagrégation plaquettaire prolongée ?
Plusieurs études évoquées dans les recommandations ne correspondent plus à nos pratiques (exemple ATLAS-ACS 2-TIMI 51)(16), car ayant fait appel à la ticlopidine ou au clopidogrel au lieu des nouveaux antiplaquettaires. Le registre RENAMI(17) montre bien que la poursuite de la DAPT (tableau 2) diminue surtout les récidives d’infarctus(15) tout en accroissant les hémorragies sévères.
Un travail plus ancien(15) a bien mis en évidence l’effort thérapeutique nécessaire et le risque hémorragique encouru en prolongeant la DAPT (tableau 3) en lieu et place de l’Aspirine seule au long cours.
Le bénéfice d’une DAPT prolongée est donc plutôt modeste en payant le prix sous forme d’hémorragies, certes moins fréquentes que prévu – est-ce identique dans la vraie vie ? À l’ère des stents actifs, il n’est pas recommandé d’étendre cette stratégie à tous les patients post-SCA ST-, mais de la discuter chez ceux qui sont à haut risque ischémique. Ceci aurait dû être plus nettement précisé dans les « Recos ».
La classification II a est excessivement optimiste. Le traitement post-SCA est lourd et ne peut inclure que des molécules dont l’efficacité est très significative (statines, bêtabloqueurs, antidiabétiques, IEC..., et à terme anxiolytiques !) Pourquoi l’alourdir par une classe thérapeutique majeure et qui n’est pas sans risque, alors que les patients sont plus âgés et que de plus en plus de femmes sont concernées. Une classification II c aurait été plus près de la réalité scientifique.
Que pourrait apporter dans ce contexte l’adjonction d’un NOAC à l’aspirine en lieu et place d’un inhibiteur du P2Y12 ? Je pourrais développer l’argumentation : chez un patient revascularisé complètement après un SCA ST- et asymptomatique au terme d’un an de DAPT, aucune donnée incontestable ne permet aujourd’hui de proposer cette association(18).
En étant complotiste – c’est à la mode mais je ne le suis pas–, à qui a-t-on voulu faire plaisir ? Cette remarque ne remet pas en cause le travail considérable fourni par cette équipe multinationale qui nous permet de disposer d’un très grand nombre d’informations.
Conclusion
▹ Dans ces dernières recommandations à propos de la prise en charge du SCA ST- on aurait pu faire l’économie de plusieurs paragraphes encombrants et connus de tous (sauf de nos internes dont nous allons compléter la formation).
▹ Le chapitre concernant le traitement antithrombotique nous laisse sur notre faim.
▹ Quand, concernant certaines stratégies ou molécules, les résultats des essais cliniques (ou les avis de la HAS) ne sont pas incontournables, il paraît inutile de faire plus que de les citer et les faire disparaître des tableaux de synthèse (par ailleurs difficiles à lire). Cela donnera envie d’attendre des recommandations européennes (et pourquoi pas françaises) ciblées sur ce thème majeur du traitement antithrombotique qui fera encore couler beaucoup d’encre...
▹ En paraphrasant un éditorial récent, gardons-nous de croire que “One Size Fit All”(19). Chaque patient est différent. Nous disposons d’outils de plus en plus efficaces à condition de les adapter à chacun.
* ndlr : La citation originale tirée de Le Nom de la rose de Umberto Eco est « Le chemin de la science est malaisé et il est souvent difficile d’y distinguer le bien du mal ».
Les appels de tableaux en vert renvoient sur la publication originale des recommandations 2020 de l’ESC : Collet JP et al. 2020 ESC guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J 2021 : 42 : 1289-367.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


