Focus-Nouvelle technique
Publié le 31 mar 2008Lecture 7 min
Valve aortique par voie transcutanée
A. TIROUVANZIAM, Hôpital Guillaume et René Laennec, CHU Nord, Nantes
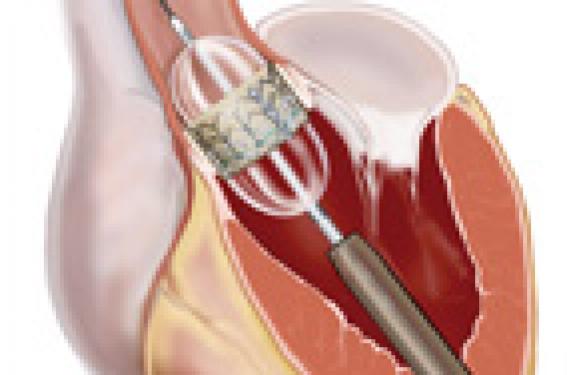
L’allongement de la durée de vie et le déclin de la maladie rhumatismale ont fait de la sténose aortique calcifiée dégénérative la première cause de valvulopathie acquise dans les pays occidentaux. Son incidence est estimée à 5 % après 75 ans.
En l’absence de traitement chirurgical, la survie moyenne est de 23 ± 5 mois après la survenue des premiers symptômes.
Toutefois, le remplacement valvulaire aortique (RVAO), actuel gold standard avec un recul de près de 40 ans, et qui a fait la preuve de son efficacité dans cette indication, voit son risque s’élever à mesure que s’additionnent les critères de comorbidités et que s’élève l’âge du patient.
Après 80 ans, la mortalité opératoire est de 5 à 10 % en cas de remplacement valvulaire aortique isolé, de 10 à 20 % si une revascularisation par pontage est associée, et peut atteindre 30 % en cas de dysfonction ventriculaire gauche sévère(1).
La valvuloplastie aortique percutanée (VAP) a été développée par Alain Cribier dès 1985(2) pour ces patients à très haut risque chirurgical ou chez qui la chirurgie est contre-indiquée.
Si l’efficacité de la VAP à court terme s’est avérée limitée par la resténose(3), elle apporte néanmoins un bénéfice net et immédiat sur l’amélioration des symptômes avec une morbidité réduite à 2,2 %.
La technique établie et développée initialement par l’équipe de Rouen a été simplifiée au fil des années, par la réduction du shaft des ballons (donc des introducteurs), l’allègement des protocoles d’anticoagulation, les systèmes de fermeture percutanée et l’utilisation d’une stimulation ventriculaire droite rapide, permettant de stabiliser le ballon dans l’orifice aortique et d’optimiser ainsi, son déploiement.
Enfin, la valvuloplastie aortique percutanée connaît actuellement un net regain d’intérêt car elle est un prérequis indispensable avant l’implantation d’une valve par voie (per)transcutanée.
Valve par voie transcutanée dans la sténose aortique calcifiée
Les premières tentatives d’implantation de valve par voie percutanée remontent chez l’animal aux années 1960(4), puis en 1992 avec Andersen et al.(5).
L’ère, plus récente, de l’implantation humaine fut initiée en 2000 par Bonhoeffer et al.(6) pour la sténose pulmonaire dans le cadre de cardiopathies congénitales.
En 2002, Cribier et al. décrivirent la première implantation humaine dans la sténose aortique calcifiée par voie veineuse transseptale antérograde(7).
À ce jour, seuls deux systèmes ont fait l’objet d’études approfondies pour la sténose aortique et ont obtenu le marquage CE en France : la Edwards Transcatheter Heart Valve (Percutaneous Valve Technologies, Edwards Life Science, Irvine, CA) et la CoreValve Percutaneous ReValving™ System (CoreValve. Inc, Irvine CA).
Edwards Transcatheter Heart Valve (THV)
Il s’agit d’une valve tricuspide en péricarde bovin, suturée dans un stent en acier inoxydable, avec ballon expandable. Cette valve peut être insérée par voie artérielle rétrograde (Edwards Sapien, THV, Retroflex), antérograde veineuse (transseptale) ou transapicale (Edwards Sapien, THV, Ascendra). Elle est disponible en deux tailles de 23 et 26 mm de diamètre, compatibles respectivement 22 et 24 French.
La valve se fixe après une prédilatation de l’orifice aortique par expansion du ballon dans les sigmoïdes aortiques calcifiées, au niveau du plan annulaire, sous l’origine des ostia coronaires et de la jonction sinotubulaire.
La première publication concernant une série de 36 patients compassionnels inopérables(8) implantés par voie veineuse antérograde transseptale a démontré une amélioration tant hémodynamique (surface 0,6 ± 0,11 cm2 à 1,7 ± 0,10 cm2, gradient moyen transvalvulaire 37 ± 13 mmHg à 9 ± 2 mmHg ; p < 0,00001), que clinique (classe NHYA III à I ou II dans plus de 90 % des cas), sans occlusion coronaire. La mortalité à distance dans cette population compassionnelle est essentiellement d’origine extracardiaque.
Effectivement, avec un recul de près de 4,5 ans, on ne note ni migration secondaire, ni dysfonction valvulaire, ni variation de la surface aortique effective.
Depuis 2002, l’implantation peut donc également se faire par voie artérielle rétrograde, ou transapicale. La voie rétrograde totalise à ce jour, plus de 350 patients inclus dans les différentes études, avec un taux de succès d’implantation de 91 %, les complications étant limitées (occlusion coronaire : 1,1 % ; pacemaker : 3,4 % ; conversion chirurgicale : 1,1 % ; complication vasculaire : 7,5 % ; accident vasculaire cérébral [AVC] : 1,1 %) et avec un taux de survie de près de 80 % à 1 an(9).
À noter, un grade I d’insuffisance aortique dans 70 % des cas et l’absence de fuite dans 30 % des cas.
La voie transapicale totalise, quant à elle, plus de 150 patients implantés avec 93 % de succès d’implantation, 8,8 % de conversion pour un remplacement valvulaire conventionnel, 1,2 % d’AVC et un taux de survie à 1 an de 61,6 %(10).
L’évolution technologique de ce système se fait vers une réduction du shaft de 3 à 5 F et l’utilisation d’un système Retroflex, facilitant le passage de l’arche aortique et le franchissement de l’orifice calcifié.
Approches actuelles transcutanées et transapicales : Edwards.
CoreValve Revalving Percutaneous System
Il s’agit d’une valve tricuspide en péricarde porcin, suturée dans un stent auto-expandable en nitinol. Elle est implantée exclusivement par voie artérielle rétrograde. Elle est disponible en deux tailles de 26 et 29 mm de diamètre.
Après une réduction de 7 F (1re et 2e générations respectivement de 25 et 21 F), le cathéter de pose de 3e génération présente un diamètre actuel de 18 F, permettant désormais de ne plus avoir recours à une assistance circulatoire comme initialement requise (Tandem Heart ou assistance fémoro-fémorale).
La valve se déploie après une prédilatation de l’orifice aortique par retrait du système de contention dans la valve native calcifiée, sur une hauteur s’étendant de la chambre de chasse en dessous du plan des sigmoïdes, jusqu’à la jonction sinotubulaire et l’origine de l’aorte ascendante, au-dessus du plan des ostia coronaires. À ce jour, plus de 500 patients ont été traités par ce système.
Les premières études de faisabilité et de sécurité concernant des patients avec un Euro score compris entre 23 et 27 %, ont démontré, avec un recul de 6 mois, une amélioration hémodynamique (surface de 0,7 cm2 à 1,8 cm2 ; gradient moyen transvalvulaire de 43 mmHg à 11 mmHg) et une amélioration clinique (amélioration de la classe NYHA) constantes. Le taux d’absence d’événements cardiaques majeurs est de 64,7 %, le succès d’implantation périopératoire de 76,5 % et le taux de survie à 6 mois de 76,5 %(11).
À ce jour, on recense au moins neuf autres prototypes de valve percutanée en expérimentation à travers le monde à des degrés d’avancement divers, mais aucun ne peut prétendre encore à un éventuel marquage CE, à l’instar des deux valves précitées.
Les valves marquées CE.
Implantation par voies antérograde (à gauche) et rétrograde (à droite).
Aspect réglementaire des valves percutanées
Les deux sociétés distributrices Edwards Life Science et Core Valve Incorporation ont obtenu pour leur valve respective le marquage CE en 2007. Celui-ci est la condition sine qua non pour initier une procédure de remboursement en France auprès de la CEPP (Commission d’évaluation des produits et prestations) et du CEPS (Comité d’évaluation des produits de santé), et obtenir l’inscription sur la LPPR (Liste des produits et prestations remboursables).
L’HAS (Haute autorité de santé) a publié sur son site l’avis du CEPP concernant les deux dispositifs de valves percutanées qui est une ASA (Amélioration du service attendu) de niveau 1, reconnaissance d’une avancée thérapeutique majeure pour cette population cible.
En parallèle à l’inscription sur la LPPR, un dossier de deman-de rempli par les sociétés savantes (de cardiologie interventionnelle et de chirurgie cardiaque) a été déposé.
La création d’un code nomenclature CCAM (Classification commune des actes médicaux) et l’obtention d’un remboursement auprès de l’HAS et de l’UNCAM (Union nationale des Caisses d’assurance maladie) sont en cours de réalisation.
Enfin, il est nécessaire de créer un GHS (Groupe homogène de séjour), et un GHM (Groupe homogène de patient), spécifiques à cette nouvelle thérapie, afin d’évoluer dans le cadre légal de la T2A (Tarification à l’activité), permettant ainsi une prise en charge par la Sécurité sociale.
Conclusion
Le concept de la valve aortique transcutanée représente une avancée thérapeutique majeure dans la prise en charge des patients ayant des contre-indications ou à haut risque pour une chirurgie de remplacement valvulaire aortique conventionnelle.
Sa diffusion large reste néanmoins limitée aujourd’hui par de multiples facteurs : processus long de validation réglementaire, coût élevé des prothèses (22 000 euros), longue courbe d’apprentissage technique, sélection rigoureuse des patients (tant sur le plan clinique que vasculaire périphérique) et séries publiées dans la littérature très encourageantes, mais encore limitées dans leurs effectifs et dans le temps.
Si l’on considère, comme le suggèrent les données de l’Euro Heart Survey(12), que 31,8 % des patients présentant un rétrécissement aortique calcifié, serré et en classe III de la NYHA ne peuvent être opérés, près de 5 000 patients pourraient chaque année bénéficier de cette nouvelle technique.
Les perspectives à long terme de la valve par voie transcutanée sont également intéressantes en termes d’indications autres que la sténose aortique dégénérative sur valve tricuspide : resténose de bioprothèse, sténose sur bicuspidie aortique, insuffisance aortique, rétrécissement aortique congénital, patient à risque opératoire moins élevé.
Il reste néanmoins à prouver, sur le long terme, l’innocuité (absence de migration, d’occlusion coronaire, de trouble de conduction par compression du septum, de traumatisme de la racine aortique ou du ventricule gauche, d’insuffisance aortique paravalvulaire, d’hémolyse ou de traumatisme de l’appareil mitral) et l’efficacité de ces nouveaux dispositifs en comparaison de la chirurgie, par de (très) larges études randomisées.
Nul doute que nos autorités de tutelle qui ont compris l’enjeu majeur qui se joue actuellement pour les patients, nous aideront dans ce travail de longue haleine.
Remerciements : Bruno Bechade, Société Edwards Life Sciences.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


