Technologies
Publié le 22 déc 2023Lecture 11 min
L’athérectomie orbitale dans l’artériopathie périphérique : l’arlésienne ?
Gilles GOYAULT, Institut cardiovasculaire de Strasbourg, Clinique RHENA
Depuis maintenant plusieurs années, nous lisons dans les revues spécialisées ou entendons parler en congrès de l’athérectomie orbitale comme option de préparation du vaisseau dans l’algorithme de la prise en charge endovasculaire de l’artériopathie oblitérante des membres inférieurs (AOMI), sans toutefois, pour la majorité d’entre nous, l’avoir vue et encore moins utilisée… Et pourtant, l’athérectomie orbitale est utilisée depuis 2007 aux États-Unis, où elle est d’ailleurs le système de désobstruction le plus utilisé.
Alors, pourquoi un tel retard en France ?
D’une manière générale, la pénétration de l’innovation dans notre pays, en tout cas dans le domaine des traitements endovasculaires, est grevée par une politique contraignante de remboursement des dispositifs non implantables et les dossiers de demande de prise en charge en sus font fuir la plupart des petits acteurs (souvent les plus innovants), allant chercher des marchés plus ouverts ailleurs. Distribué depuis 2018 en Europe par la société OrbusNeich, le système d’athérectomie orbitale dénommé Stealth 360© en périphérique (Diamondback® en coronaire) a été développé par la société américaine CSI (Cardiovascular Systems, Inc.). La pathologie coronaire étant beaucoup plus fréquente que la maladie artérielle périphérique, l’essentiel des ressources du support technique de la société de distribution s'est concentré sur le traitement des lésions calcifiées des coronaires. Mais, les choses vont changer dès 2024, la société Abbott Vascular ayant depuis peu racheté la société CSI, ce qui devrait permettre une diffusion plus large de ce dispositif au profit de nos patients, même si un remboursement n’est pas encore à l’ordre du jour.
Comment ça marche ?
L’athérectomie orbitale (AO) est basée sur le principe de la force centrifuge par rotation à haute vitesse d’une couronne diamantée excentrique fixée sur un cathéter tournant autour d’un guide. Elle induit par sa rotation et le contact de la couronne avec la paroi une abrasion des lésions calcifiées et fibreuses de l’intima et de la media sous forme de microfragments naturellement absorbés par le système réticulo-endothélial. Elle n’est pas munie de système d’aspiration et la plupart des équipes n’utilisent pas de filtre (risque embolique faible). Cependant, afin de ne pas saturer ce système réticuloendothélial, ce dernier est utilisé par périodes de 30 secondes d'activation (avancée d'environ 1 cm/s) et de repos (minimum 30 s).
Il n’est pas recommandé d’utiliser le système sur une durée de plus de 8 minutes ou de rester en place plus de 2-3 secondes à très haute vitesse afin d'éviter l'abrasion trop importante de la plaque. La profondeur de pénétration de la couronne est déterminée par la vitesse de rotation (3 disponibles : low, medium, high, correspondant à des vitesses de 60 000, 90 000 et 140 000 tours/min). Plus la vitesse est élevée et plus la profondeur d’athérectomie sera importante. Une fois la couronne mise en place le long du guide à la partie proximale de la lésion à traiter, la longueur utile d’abrasion est de 15 cm ; la couronne étant avancée manuellement à l’aide d’un bouton courant le long d’une glissière (figure 1).
Figure 1. Vue détaillée du système d’athérecto mie orbitale Stealth 360® et des différents types de couronne.
Si la lésion mesure plus de 15 cm, il faudra avancer l’ensemble couronne et poignée de contrôle à la partie distale de la première portion traitée.
La mise en œuvre du dispositif d’AO est très facile et ne prend que 2 à 3 minutes. Un guide dédié 0,014 (en 335 ou 475 cm de long) doit être utilisé et le système nécessite la perfusion continue de sérum et de lubrifiant (attention aux allergies à l’œuf et au soja). Les couronnes sont disponibles en diamètre 1,25 ; 1,5 ; 1,75 et 2 mm. Il existe des couronnes Classic, Solid et Micro (uniquement en 1,25 mm et disposant d’une fonction Glideassist améliorant la navigabilité dans les lésions très distales, notamment sous la cheville). L’AO peut être utilisée dans des vaisseaux allant de 2 à 10 mm de diamètre et avec des introducteurs de 4 à 6 Fr en fonction du diamètre de la couronne. Le porteur est disponible de 145 à 200 cm, autorisant l’utilisation de l’AO par voie radiale ou en crossover, y compris pour des lésions très distales.
Qu’érode réellement la couronne abrasive, quel effet sur la paroi et comment choisir le bon diamètre (figure 2) ?
Figure 2. Tableau indicatif du diamètre de couronne recommandé en fonction du vaisseau cible.
L’étude TRUTH, publiée en 2015, a évalué par histologie virtuelle, l’évolution de 29 lésions traitées par AO à l’aide d’une exploration IVUS avant et après athérectomie. Les résultats montrent que l’ablation du calcium a représenté 86 % de l’augmentation de la surface après AO. La lumière minimale a augmenté de 4,0 mm² à 9,1 mm² (p < 0,0001) après AO + angioplastie au ballon et le pourcentage de sténose a diminué de 76,9 % à 43 % après athérectomie.
Ces résultats étaient obtenus par inflation d’un ballon d’angioplastie à 5,2 ± 1,2 atm, témoignant d’une modification de la compliance pariétale . Ces effets de l'AO sur la plaque ont été confirmés par l’étude CONFIRM et portant sur une série de 3 135 patients traités dans 200 centres américains différents.
CONFIRM a permis d'isoler des facteurs d’optimisation de la technique d’ablation par AO par réduction de la durée d’application de l’athérectomie et du diamètre de la couronne permettant de limiter le taux des complications incluant le slow flow (4,4 %), l’embolie (2,2 mm) et le spasme (6,3 %).
Que nous apprend la littérature sur les résultats cliniques après athérectomie orbitale ?
D’une manière générale, les différents systèmes d’athérectomie percutanés ont été développés et sont utilisés pour réduire le volume des plaques d’athérome et/ou retirer du matériel thrombotique ou hyperplasique obstruant la lumière des vaisseaux artériels ; par opposition aux ballons ou stents qui ne vont qu’écraser et étaler la plaque. Les objectifs de cette préparation du vaisseau par athérectomie sont d’aider au traitement des lésions calcifiées et complexes, d’améliorer (en théorie) la pénétration pariétale de la drogue des dispositifs à élution et de réduire l’utilisation des stents, en particulier dans des territoires peu favorables comme l’artère fémorale commune ou l’artère poplitée.
La littérature converge vers une amélioration du succès technique des angioplasties de lésions complexes préparées par athérectomie, d’une diminution du taux de stenting mais sans toutefois permettre d’améliorer les taux de perméabilité ou de réintervention (TLR) à moyen et long terme comparativement au traitement par ballon simple.
Concernant plus spécifiquement l'AO, l’étude OASIS de 2009 (124 patients en ischémie critique, traités par AO pour des sténoses infrapoplitées, dans 57 % des cas sans traitement complémentaire associé), rapporte un taux de sténose résiduelle < 30 % de 90 % et une amélioration du score de Rutherford dans près de 80 % des cas à 6 mois sans amputation dans le suivi. Des résultats à court terme mais prometteurs dans cette population de patients au pronostic plutôt sombre.
En 2012, l’étude randomisée CALCIUM 360 compare les résultats à 1 an de 50 patients en ischémie critique traités par AO + angioplastie au ballon vs angioplastie au ballon seul (atteinte poplitée et jambière). Bien que statistiquement non significatif, le taux de succès technique dans le groupe AO atteint 93,1 % vs 82,4 % dans le groupe ballon seul. Le taux de stenting de sauvetage est bien moindre dans le groupe AO + ballon vs ballon seul (6,9 % vs 14,3 %) et le taux d’absence de réintervention également inférieur (93,3 % vs 80 %) à 1 an en AO.
Nous savons que l’utilisation du ballon d’angioplastie seul dans les lésions fémoropoplitées calcifiées augmente le risque de dissection, de barotraumatisme pariétal et donc l’utilisation de stents. En 2014, l’étude randomisée COMPLIANCE 360 tente d’évaluer le bénéfice potentiel de l’utilisation combinée de l’AO + ballon simple vs ballon seul, par modification de la compliance pariétale. Cinquante patients (65 lésions) atteints de sténoses calcifiées fémoropoplitées ont été randomisés dans les deux groupes. La pression d’inflation maximum du ballon d’angioplastie dans le groupe OA + ballon était de 4 atm vs 9,1 atm dans le groupe ballon seul (p < 0,001). Malgré cette différence, et bien que le taux d’absence de réintervention à 6 mois ait été de 77,1 % dans le groupe OA + ballon vs 11,5 % dans le groupe ballon seul, ces taux se sont quasi égalisés à 1 an à, respectivement, 81,2 % vs 78,3 % ; ce, malgré un taux de stenting très supérieur dans le groupe ballon seul. L’AO permet donc une amélioration du résultat immédiat de l’angioplastie au ballon seul en réduisant drastiquement le taux de stenting mais avec un résultat comparable en termes de resténose et de taux de réintervention, sachant que l’on s’attendrait à ce que le stent fasse mieux que le ballon dans ces angioplasties de lésions calcifiées. L’athérectomie orbitale fait donc aussi bien avec bien moins de stents.
En 2020, Giannopoulos et coll. publient les résultats à 3 ans de patients traités par AO et inclus initialement dans la cohorte LIBERTY 360. Dans cette cohorte, 503 patients ont bénéficié d’une prise en charge par AO dans le cadre d’une claudication intermittente ou d’une ischémie critique avec trois groupes analysés en fonction de la sévérité de l’artériopathie : Rutherford 2-3, 4-5 et 6, soit un total de 214 patients en ischémie d’effort (RC 2-3) et 289 patients en ischémie critique (RC 4-5 et 6) pour 617 lésions traitées (respectivement 251, 289 et 77). Environ 54 % des lésions étaient situées en infrapoplité, 32,1 % à l’étage fémoropoplité et 13,3 % au-dessus et en dessous du genou. Dans cette étude, un ballon d’angioplastie était utilisé dans plus de 98 % des cas après AO, avec un taux de stenting de sauvetage de seulement 2 %, 2,8 % et 0 % dans les groupes RC 2-3, RC 4-5 respectivement, et 100 % dans le groupe RC 6. L’étude conclut que l’AO permet une amélioration des taux de succès immédiat de l’angioplastie, avec un très faible taux de stenting de sauvetage ; et ce, quel que soit le score de gravité clinique.
Le taux de stenting intentionnel des lésions était par ailleurs de 10,6 %, 9,2 % et 17,8 % respectivement. Les taux de complication étaient globalement comparables dans les trois groupes à environ 10 % dont un taux d’embolisation distale de respectivement 6,5 %, 5,6 % et 8,1 % dans les différents groupes. Les taux de survie sans amputation à 3 ans étaient de 100 %, 95,3 % et 88,6 % dans les groupes RC 2-3, RC 4-5 et RC 6. D’une manière générale, les risques d’événements majeurs étaient d’autant plus élevés que le stade Rutherford était important, reflétant la gravité de l’ischémie critique. Les taux de cicatrisation des plaies à 1 an dans les groupes en ischémie critique (ayant consulté un centre de cicatrisation) étaient de 63 % dans le groupe RC 4-5 et 75 % dans le groupe RC 6. À 2 ans, ces taux étaient respectivement de 90 % et de 100 %. L’étude conclut que l’AO permet une amélioration des taux de succès immédiat de l’angioplastie, avec un très faible taux de stenting de sauvetage ; et ce, quel que soit le score de gravité clinique. L’étude suggère également que l’AO est un dispositif sûr et efficace pour tous les patients atteints d’AOMI, qu’ils soient claudicants ou en ischémie critique.
Conclusion
L’athérectomie orbitale n’est donc pas une arlésienne et son développement en France à partir de 2024 nous permettra de proposer à nos patients les plus complexes une arme supplémentaire efficace contre le calcaire (en attendant le « calgon » qu’ils nous réclament souvent !). On peut donc retenir de la lecture de la littérature publiée sur l’utilisation de l’athérectomie orbitale dans le traitement des lésions périphériques, que ce dispositif permet d’améliorer le succès technique des angioplasties des lésions calcifiées/fibreuses, et donc d’élargir la population de patients à qui proposer un traitement endovasculaire efficace. Ces résultats s’obtiennent au prix d’une importante réduction du stenting de sauvetage grâce à la réduction du volume de la plaque, mais surtout grâce à la modification de la compliance pariétale favorisant l’angioplastie basse pression. L’objectif premier de l’AO est bien la modification de la compliance pariétale et non l’ablation maximale de plaque (exposant à un risque majoré de complications). Ce traitement s’adresse aux patients claudicants mais également et surtout aux patients en ischémie critique avec des taux de sauvetage de membre très encourageants (cette population étant plus fréquemment diabétique, en insuffisance rénale et ayant une artériopathie majoritairement calcifiée). Les lésions cibles sont donc calcifiées et/ou fibreuses, sténosantes et occlusives avec un faible taux d’embolie distale, sous réserve de bien respecter les consignes d’utilisation. En revanche, dépourvue de système d’aspiration, l’athérectomie orbitale n’a pas de place dans le traitement de la resténose intrastent ou la thrombose in situ et elle n’a pas d’effet sur les tissus mous. Sa large gamme de diamètre et de longueur utile de travail permet son utilisation de l’étage iliaque aux artères sous la cheville, par abord fémoral, radial ou rétrograde distal (pédieux/tibial). Il s’agit bien entendu d’un dispositif de préparation du vaisseau s’utilisant avant une angioplastie au ballon actif et/ou à l’aide d’un stent (nu ou actif). Enfin, pour celles ou ceux intéressés par cette technologie, les 5 premiers cas doivent être supervisés par un spécialiste clinique validé par Abbott Vascular avant de pouvoir l’utiliser seul.
Cas clinique : Patiente de 79 ans adressée pour claudication sévère du membre inférieur droit avec un périmètre de marche à 150 m et retard de cicatrisation d’une ulcération malléolaire droite (figures 3 et 4).
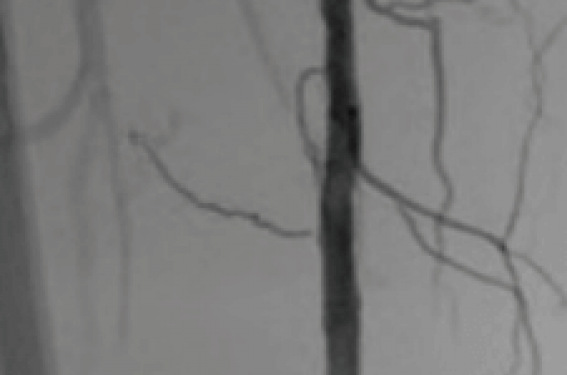
Occlusion calcifiée de 5 cm de longueur (PACSS grade 4) de l’artère fémorale distale droite. Mise en place d’un introducteur 6F en crossover à droite (Fortress, Biotronik). Franchissement endoluminal de l’occlusion à l’aide d’un guide 0,014 Winn 200T (Abbott Vascular) puis réalisation d’une athérectomie à l’aide d’une couronne Stealth 360® 1,5 mm Solid à basse et moyenne vitesses sur la zone d’occlusion. Angioplastie complémentaire prolongée à l’aide d’un ballon de 5 x 100 mm. Dissection résiduelle au contrôle ayant motivé la mise en place d’un stent SuperaTM 5 x 40 mm (Abbott Vascular) et postdilatation à l’aide d’un ballon actif RangerTM 5 x 150 mm (Boston Scientific). Excellent résultat final sans embolie distale. Retour à domicile le lendemain matin, la patiente étant seule à domicile. Suites simples à distance.
Figure 3. Angiographie sélective de l’artère fémorale superficielle droite montrant une occlusion calcifiée d’environ 5 cm du tiers inférieur. A : calcifications circonférentielles. B : temps précoce permettant le repérage du pôle supérieur de l’occlusion. C : temps plus tardif permettant le repérage de la réinjection distale.
Figure 4. A : passage de la couronne Stealth 360® 1,5 mm Solid. B : contrôle angiographique après athérectomie. C : contrôle angiographique après angioplastie au ballon. Persistance d’une dissection avec sténose résiduelle > 30 %. D : contrôle final après mise en place d’un stent SuperaTM (5 x 40 mm) et angioplastie au ballon actif.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


