Publié le 30 sep 2016Lecture 7 min
Valeur pronostique du saignement chez le patient traité par antithrombotiques
B. ESSAYAGH, D. SCARLATTI, D. BAUDOUY, P. BOUVIER, N. REDJIMI, É. FERRARI, Service de cardiologie, CHU de Nice
Les médicaments antithrombotiques sont en constante évolution mais l’augmentation de leur efficacité s’accompagne aussi le plus souvent d’un risque accru de saignement.
La survenue d’un saignement est une complication potentiellement très grave dans la prise en charge d’un syndrome coronarien aigu (SCA) en miroir de l’événement ischémique. Bien au-delà de la perte sanguine elle-même, la survenue d’un saignement a une implication forte en termes de pronostic à court et à long terme.
Dans l’arythmie complète par fibrillation atriale (ACFA) traitée par AVK ou AOD, la prévalence de l’événement « saignement grave » devient plus fréquente que l’événement thromboembolique. Les anticoagulants diminuent en effet de 60 à 75 % le taux d’AVC ou d’embolies périphériques dont la prévalence est de l’ordre de 1 à 1,5 % alors que le risque hémorragique atteint une prévalence de l’ordre de 2 à 3 %. Le traitement efficace de la FA a donc transformé une maladie à risque embolique majeur en maladie hémorragique.
Définition du saignement majeur
Il existe une dizaine de définitions différentes du saignement dans le SCA. Les études qui s’y sont initialement intéressées ont en effet donné des définitions personnelles pas toujours coordonnées. TIMI, GUSTO, ISTH, GRACE, PLATO, ACUITY, STEEPLE, BLEEDSCORE sont autant de classifications des événements hémorragiques.Récemment et dans un souci d’uniformisation, un consensus a permis l’émergence d’une définition standardisée des saignements : le Bleeding Academic Reaserch Consorcium (BARC). Ce dernier prend en compte le saignement lié à la chirurgie cardiaque (tableau 1).
Un saignement majeur se définit comme un saignement compromettant l’hémodynamique du patient, de localisation intracrânienne, nécessitant une transfusion de plus de deux culots globulaires, entraînant une perte de 3 à 5 points d’hémoglobine (selon l’échelle utilisée), ou nécessitant un recours à une thérapeutique chirurgicale.
La définition adoptée du saignement majeur dans la FA est la même que celle utilisée dans le SCA.
Quels sont les patients qui saignent ?
L’âge apparaît comme un facteur de risque majeur. L’incidence augmente de 30 % par tranche de 10 ans.
Le sexe féminin est classiquement associé à un risque de saignement accru (environ + 40 %). Les patients insuffisants rénaux saignent deux fois plus que ceux avec une fonction rénale normale, avec un OR de 1,4 pour chaque augmentation de 1,13 mg/dl de la créatininémie. Les mauvaises adaptations posologiques des antithrombotiques participent à ce sur-risque.
Bien que plus souvent résistants aux antiagrégants plaquettaires (AAP), les patients diabétiques saignent plus que les patients non diabétiques.
La génétique peut individualiser chez certains patients et avec certains traitements un plus haut risque de saignements. Les mutations connues VKORC s’accompagnent d’une sensibilité majorée au traitement par AVK.
Certaines mutations du cytochrome CYP2C19*17 chez les patients traités par clopidogrel augmentent l’inhibition plaquettaire et le risque de saignement sans améliorer l’efficacité du médicament.
Enfin, un antécédent de saignement, ainsi que l’utilisation de certains antithrombotiques représentent clairement un sur-risque (tableau 2).
Les situations à risque ?
La phase aiguë du SCA est clairement une situation à risque puisque d’imposants cocktails antithrombotiques sont souvent utilisés. A fortiori parce que des examens invasifs sont pratiqués. La pondération dans la mise en route des thérapies à risque hémorragique est de rigueur surtout lorsque le diagnostic n’est pas certain.
Concernant les explorations coronaires, la voie fémorale versus la voie radiale induit clairement une augmentation du risque de saignement (environ 50 % de saignement majeur, 70 % de saignement sur le site d’accès, 40 % de recours à la transfusion) avec une augmentation de la mortalité immédiate et à 1 an. Ceci est particulièrement vrai chez les patients les plus âgés (> 75 ans). Pendant la phase hospitalière d’un SCA, une importante majorité des saignements sont dues à des erreurs posologiques. Une analyse du registre américain CRUSADE ayant rassemblé 30 136 patients souffrant d’angor instable conclut que 42 % des sujets traités par des antithrombotiques reçoivent au moins une fois une dose excessive de ces médicaments. Ces surdosages concernent 32,8 % des patients sous héparine standard, 13,8 % sous HBPM et 26,8 % des patients sous anti- GPIIb-IIIa. Ils sont clairement à l’origine d’un surplus d’hémorragies majeures (11,5 % des patients présentaient un saignement grave contre les 5 % rapportés dans les grands essais cliniques habituellement) et d’une surmortalité.
Après la phase aiguë d’un SCA ou chez les patients en FA, les procédures de revascularisation ou les actes à risque hémorragique sont par définition des circonstances qui augmentent le risque hémorragique qu’il faut savoir gérer au mieux. La prise en charge des traitements antithrombotiques découle de la balance des 2 risques : thrombotique et hémorragique.
Différents consensus permettent de gérer ces situations en évitant les grosses erreurs. Les règles principales qui permettent de gérer au mieux ces situations sont que :
- il est souvent possible de retarder des actes lorsque le patient est sous bithérapie antiagrégante ou bien lorsqu’on vient de débuter un traitement anticoagulant pour une FA ;
- les relais sont loin, très loin d’être anodins ;
- la plupart des actes à risque hémorragique peuvent et doivent se faire sans arrêter l’antithrombotique ;
- lorsque le risque hémorragique est élevé et que l’arrêt des antithrombotiques est décidé on peut très souvent se passer d’un relais.
Incidence du saignement
L’incidence du saignement majeur chez le patient coronarien en phase aiguë est de l’ordre de 4 à 5 % (analyse du registre ACUITY) et varie selon le traitement AAP.
L’incidence du saignement grave sous AVK dans la FA est de l’ordre de 3-4 % par an. La diminution du risque thrombotique sous traitement varie de façon inversement proportionnelle avec l’augmentation du risque hémorragique.
Avec les AOD, le pourcentage de saignement majeur annuel est respectivement de 2 à 3,5 % selon les études. Cette classe thérapeutique est l’une des rares qui permet de réduire à la fois le risque thrombotique et le risque hémorragique. En particulier la diminution de plus de 50 % du risque d’hémorragie cérébrale sous AOD vs AVK est une avancée majeure.
Ces taux peuvent et devront encore dans le futur être diminués mais ils font partie des risques inhérents à la décision de mise en route du traitement antithrombotique. Décision qui doit être réfléchie et pondérée et qui doit régulièrement être réévaluée.
Pronostic du saignement
La réponse physiologique à un saignement est l’activation de l’hémostase primaire et de la coagulation, donc une tendance générale à créer du thrombus. Le saignement qui survient chez un patient traité pour un SCA ou une FA entraîne par ailleurs le plus souvent l’arrêt des traitements antithrombotiques. Ces 2 phénomènes conjugués favorisent les récidives ischémiques et thromboemboliques.
Ainsi, les récidives ischémiques à 30 jours surviennent chez 1 coronarien sur 4 qui aura présenté un saignement. La thrombose de stent est un risque majeur chez le patient présentant un saignement majeur. Le saignement est donc un marqueur du risque d’ischémie.
A fortiori, le saignement chez un patient présentant un SCA est corrélé à un pronostic péjoratif au long cours.
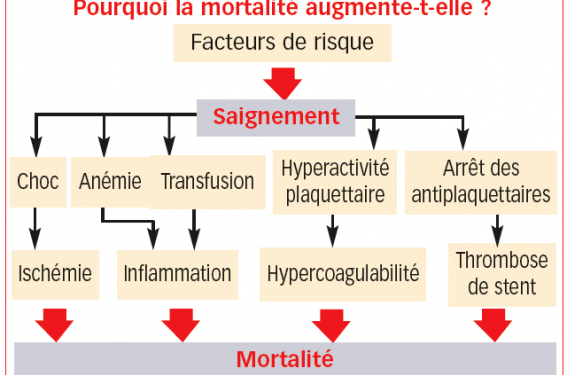
Une métaanalyse regroupant 495 630 patients dans 5 études sur le SCA avec sus-décalage du ST a montré que les saignements du site de ponction, mais aussi en dehors du site de ponction sont significativement associés à la mortalité à 1 an (figure). Le risque ajusté de mortalité à 1 an est plus élevé chez les patients avec un saignement en dehors du site de ponction par rapport aux patients avec un saignement sur le site de ponction, RR combinés de 1,66 et 1,21 respectivement.
Tout se passe comme si la survenue d’un saignement sous antithrombotique individualisait des patients à haut risque d’événements ultérieurs.
Figure. Facteurs pronostiques du saignement.
La transfusion
Contrairement à une intuition trop hâtive, la transfusion n’est pas la réponse absolue. Elle pourrait au contraire être associée à une hyperactivation plaquettaire, à une activation de la coagulation et donc à la résurgence d’événements ischémiques. Des études sont en cours pour essayer de définir le seuil d’anémie tolérable et les potentiels inconvénients d’une transfusion trop rapide.
Conduite à tenir
Devant un saignement mineur chez le patient coronarien, il est recommandé de ne pas arrêter de facto tout traitement antithrombotique (grade IC).
Devant un saignement majeur, le bon sens prime. Il faut arrêter le traitement antithrombotique (grade IC) si le saignement n’est pas contrôlé, envisager une neutralisation du traitement, recourir aux thérapeutiques spécialisées (endoscopie…) et discuter la transfusion avec prudence.
Les thérapeutiques antithrombotiques doivent être prescrites avec beaucoup de rigueur, leur suivi doit être permanent, le rapport bénéfice/risque doit être rediscuter à chaque occasion et l’adaptation de la durée du traitement doit se faire au cas par cas.
L’évaluation du risque hémorragique est une étape obligatoire. Parmi les différentes échelles permettant cette évaluation du risque hémorragique, c’est le score HAS-BLED qui a été retenu par la HAS et qui doit entrer dans la décision thérapeutique.
Conclusion
Depuis plusieurs années, la littérature souligne la non-innocuité d’un saignement autrefois considéré comme un « dégât collatéral » incontournable de tout traitement antithrombotique.
Il est maintenant reconnu comme un événement augmentant de manière très significative la mortalité à court et moyen termes en particulier en post SCA. Les patients coronariens qui saignent meurent plus, non seulement à l’hôpital mais aussi longtemps après la sortie.
Le médecin prescripteur d’anticoagulants doit appréhender ce risque à sa juste mesure et tout mettre en oeuvre pour le minimiser.
Les instances qui délivrent les AMM ont aussi compris le message. Il n’est plus envisageable actuellement de commercialiser un médicament antithrombotique qui apporterait un bénéfice mineur en termes de thrombose au prix d’un sur-risque même modéré de saignements. A contrario à résultats antithrombotiques équivalents le traitement qui apporte un bénéfice hémorragique sera plébiscité.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :