Rythmologie et rythmo interventionnelle
Publié le 09 oct 2018Lecture 9 min
Quand ablater des extrasystoles ventriculaires ?
Julien RISCHARD et coll.*, Unité de rythmologie, HEGP, Paris
Les extrasystoles ventriculaires (ESV) de l’adulte peuvent être responsables de symptômes, en particulier de palpitations, ou d’une dyspnée d’effort en cas de dysfonction ventriculaire gauche associée. Elles peuvent aussi être le marqueur d'un risque accru de mort subite, en révélant une cardiopathie sous-jacente jusque-là méconnue. C'est pourquoi, la présence d'une hyperexcitabilité ventriculaire doit faire rechercher avant tout une cardiopathie sous-jacente (qui conditionne le pronostic). En 2015, les recommandations européennes ouvrent largement la porte à l'ablation dans l’arsenal thérapeutique pour traiter les ESV symptomatiques. Avant de considérer une ablation d’ESV, les 3 points importants à évaluer sont : 1/ la symptomatologie du patient, 2/ la localisation probable des ESV, et 3/ la cardiopathie sous-jacente
Les extrasystoles ventriculaires (ESV) sont définies comme des dépolarisations myocardites prématurées d’origine ventriculaire. Bien que les ESV surviennent le plus souvent sur une cardiopathie sous-jacente, les ESV sur cœur sain ne sont pas rares. Le tableau 1 présente les principales cardiopathies associées aux ESV. Si le traitement pharmacologique permet dans la majorité des cas une réduction des symptômes, les avancées majeures dans les techniques d’ablation offre une alternative hautement efficace(1).
Avant de considérer un traitement invasif des ESV, les 3 points importants à évaluer sont : 1/ la symptomatologie du patient, 2/ la localisation probable des ESV, et 3/ la cardiopathie sous-jacente.
Tableau 1. ESV sur cardiopathie ou sur cœur sain.
Symptomatologie
Seuls les patients présentant des ESV symptomatiques seront éventuellement candidats à une ablation.
Les palpitations sont le symptôme le plus fréquemment rapporté par les patients. Les ESV sont « capricieuses », avec une grande variabilité d’apparition, sans facteur déclenchant évident le plus souvent. Les activités physiques peuvent parfois accroître les symptômes, suggérant alors une composante adrénergique. Il existe par ailleurs une importante variabilité inter- et intra-individuelle dans la symptomatologie, cette dernière étant avant tout liée au ressenti de la diastole longue qui suit. Souvent, le même patient peut décrire les mêmes ESV plus ou moins intensément dans la journée, ou ressentir différemment les ESV de morphologie différente.
Les patients peuvent aussi présenter une dyspnée, voire des signes d’insuffisance cardiaque en cas de cardiopathie sous-jacente, ou si les ESV sont compliquées d’une cardiomyopathie rythmique avec retentissement sur la fonction ventriculaire gauche.
Enfin, une syncope, éventuellement précédée de palpitations rapides, évoque une ESV « maligne », le plus souvent alors associée à une cardiopathie structurelle ou électrique. Le patient nécessite alors une évaluation par un spécialiste pour discuter également de l’indication d’un défibrillateur.
L’interrogatoire doit aussi préciser l’historique familial, à la recherche notamment de cas de morts subites précoces, pouvant orienter vers une cardiopathie héréditaire.
Localisation de l’ESV
Les caractéristiques de l’ESV (nombre de foyers, localisation supposée, caractère bénin ou non) conditionnent la complexité de la procédure et le taux de succès attendu, et donc l’information transmise au patient sur le rapport bénéfice/risque de l’ablation.
Il est ainsi capital d’enregistrer la morphologie de l’ESV sur un ECG 12 dérivations, parfois au moyen de tracés longs, voire d’un Holter 12 dérivations. Si une ESV provenant de l’infundibulum est aisément accessible et nécessite simplement un abord veineux fémoral, les ESV provenant du ventricule gauche nécessiteront une ponction transseptale ou un abord artériel rétrograde aortique.
Pour localiser rapidement une ESV, on peut proposer de façon un peu simpliste l’approche résumée dans le tableau 2 : une ESV avec aspect de retard gauche provient du ventricule droit, une ESV avec aspect de retard droit provient du ventricule gauche (classiquement, une transition des QRS après V3 suggère une origine droite, et plutôt gauche avant V3) ; un axe inférieur témoigne d’un foyer supérieur, un axe supérieur d’un foyer inférieur ; une concordance précordiale positive suggère une origine basale, une concordance négative suggère une origine apicale. Les ESV peuvent aussi avoir une origine épicardique, notamment dans les cardiomyopathies dilatées. L’aspect est alors variable mais les QRS sont alors le plus souvent particulièrement larges, avec un empâtement initial, témoignant de la conduction ralentie à distance des voies de conductions normales.
Tableau 2. Approche simplifiée de la localisation des ESV.
Les ESV dites bénignes ou idiopathiques proviennent le plus fréquemment des chambres de châsse droite ou gauche (outflow tract) (tableau 1, figure 1). Leur physiopathologie pourrait être liée à la persistance de cellules non contractiles des chambres de châsse ventriculaires (défaut d’apoptose au cours de l’embryogenèse).
Les ESV « infundibulaires », provenant de la chambre de chasse du ventricule droit, ont un aspect caractéristique de retard gauche avec axe inférieur.
Bien que l’aspect du QRS en V1 peut aider à estimer l’origine du foyer (figure 2), l’ECG reste un outil imparfait et il est parfois difficile de prédire la localisation précise : chambre de châsse gauche, cusps aortiques, sommet du ventricule gauche.
Enfin, la confrontation des données électrocardiographiques avec les techniques d’imagerie, notamment par résonance magnétique (IRM), peut aider à préciser l’origine des ESV, en révélant des foyers de nécrose/cicatrice.
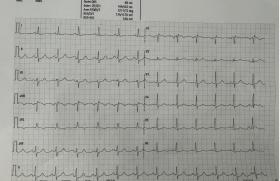
Figure 1. ESV infundibulaire sur cœur sain.
Figure 2. ESV sur cœur sain. La majorité de ces ESV proviennent des chambres de châsse ventriculaires (70 %). L’aspect du QRS en V1 peut aider à localiser plus précisément le foyer.
Cardiopathie sous-jacente
Le pronostic dépend essentiellement de la cardiopathie sous-jacente.
En effet, il n’existe pas de preuve robuste d’une corrélation directe entre ESV et mort subite. Le bilan initial doit donc rechercher une cardiopathie sous-jacente. L’échographie cardiaque est systématique. À l’inverse des ESV sur cœur sain, les ESV associées à une cardiopathie sous-jacente sont fréquemment (i) plus larges, (ii) moins amples et (iii) fragmentées. La classification de Lown propose de classer les ESV en fonction de leur profil sur le Holter-ECG, avec une corrélation pronostique : classe I (< 30 ESV/h), classe II (> 30 ESV/h), classe III (polymorphes), classe IV (doublet, triplet, TV, etc.) et classe V (phénomène R sur T). L’épreuve d’effort est utile pour évaluer l’évolution des ESV à l’effort (en faveur d’une origine bénigne en cas de disparition à l’effort) et pour rechercher une maladie coronaire associée selon le contexte. Au cas par cas, d’autres examens plus approfondis pourront être réalisés (potentiels tardifs, IRM cardiaque, coroscanner ou coronarographie, tests génétiques, etc.).
Par ailleurs, certaines ESV peuvent être à l'origine d'une cardiomyopathie dite « rythmique », c’est-à-dire compliquées de dysfonction ventriculaire, réversible après disparition des ESV. Globalement, plus la charge en ESV est importante, plus le risque de cardiomyopathie rythmique est important, mais aucun seuil n’a de valeur prédictive parfaite. Les recommandations européennes ont retenu une valeur de 24 %(2) (environ 20 000 ESV/24 h), cependant, certains cas sont décrits avec des charges en ESV relativement faibles. Parmi les autres facteurs prédictifs identifiés, on peut retenir une origine épicardique, une largeur plus importante (> 150 ms), un couplage court (< 300 ms), et un âge jeune.
En pratique, ce que disent les recommandations…
Devant l’amélioration des techniques de cartographie 3D, et des cathéters d’ablation qui sont maintenant capables de donner des informations sur la force appliquée et sa direction (figure 3), les indications tendent à s’étendre et l’approche invasive peut être maintenant proposée en première intention dans certains cas. La décision partagée doit aboutir d’une discussion médecin-patient, après information éclairée, notamment sur la probabilité de succès et les éventuels risques associés (saignements aux points de ponction, tamponnade, AVC si ablation gauche).
Le dernier groupe de travail de la Société européenne de cardiologie a proposé ces recommandations(3) :
• Sur cœur sain
Devant un taux de succès proche de 95 % et des risques de complication très limités en cas de foyer infundibulaire(4), l’ablation est désormais recommandée en première intention (classe I, B).
Concernant les ESV bénignes de la voie d’éjection gauche (cusps aortiques, chambre de châsse), l’ablation y est plus compliquée du fait de la nécessité d’un abord artériel rétrograde aortique et/ou transseptal, et la proximité de l’arbre coronaire (nécessitant parfois de réaliser une coronarographie pour évaluer la distance entre le point d’ablation et les coronaires). La procédure doit être pratiquée dans un centre expert et ne sera proposée qu’après échec d’un traitement pharmacologique (classe IIa, B). Les autres sites arythmogènes sur cœur sain sont davantage pourvoyeurs de TV que d’ESV. Néanmoins, chez des patients symptomatiques, l’ablation peut être proposée en seconde intention (classe IIa, B).
• En présence d’une cardiopathie
En cas de suspicion de cardiomyopathie rythmique, l’ablation des ESV peut être proposée en première intention(5).
Par ailleurs, les ESV du Purkinje sont retrouvées dans certaines situations aiguës et sont parfois responsables d’orages rythmiques. Dans le syndrome coronarien aigu, la persistance d’ESV isolées après revascularisation témoigne souvent d’une reperfusion incomplète. En cas d’arythmies ventriculaires récidivantes déclenchées par ces ESV relativement fines, à couplage court, provoquées par des automatismes anormaux ou activités déclenchées des fibres du Purkinje lésées, une procédure d’ablation dans un centre spécialisé s’impose (classe IIa, C). Ces ESV du Purkinje sont également incriminées dans certains arrêts cardiaques survenant sur cœur structurellement sain (FV dite idiopathique). Si le nombre d’ESV est significatif, l’ablation de l’ESV initiatrice est recommandée, indépendamment de la mise en place d’un défibrillateur automatique implantable, pour prévenir la récidive et/ou diminuer les thérapies et chocs appropriés (classe I, B).
Enfin, de nouvelles indications émergent. Alors que le syndrome de Brugada était considéré comme une canalopathie purement électrique, certains auteurs ont décrit récemment un substrat épicardique au niveau de la chambre de châsse du ventricule droit. Si seulement quelques cas ont été réalisés à l’heure actuelle, l’ablation permettrait de normaliser l’aspect ECG, mais l’impact sur la diminution du risque rythmique à long terme reste encore à évaluer. Non préconisé par les recommandations actuelles, cet exemple illustre bien les avancées constantes dans la compréhension des mécanismes électrophysiologiques responsables des arythmies, et l’essor majeur des techniques ablatives.
Principales limites
Certains facteurs peuvent limiter le taux de succès. Notamment, certains patients présentent plusieurs morphologies d’ESV. Le Holter 12 dérivations est donc particulièrement intéressant pour valider le caractère monomorphe de l’ESV ou définir les ESV cibles prioritaires. De plus, afin de localiser le foyer, la présence d’ESV pendant la procédure d’ablation est indispensable. Le Holter permettra alors de s’assurer de la répartition nycthémérale de l’ESV. Enfin, l’ablation endocavitaire peut échouer dans certaines ESV originaires de foyers profonds.
En pratique
Si le risque de mort subite dépend en général essentiellement de la cardiopathie sous-jacente, l’ablation des ESV permettra d’agir sur les symptômes associés.
L’indication de l’ablation est donc guidée par les symptômes et peut être proposée en première intention pour les ESV infundibulaires sur cœur sain, ainsi qu’en cas de suspicion de cardiomyopathie rythmique.
Malgré des résultats satisfaisants, il faut garder à l’esprit les risques potentiels d’une telle intervention lorsque l’ESV provient d’un site plus difficile d’accès ; dans ce cas, l’ablation peut être proposée en cas de symptomatologie persistante sous traitement pharmacologique. Enfin, les ESV peuvent parfois être la première manifestation d’une cardiopathie sous-jacente qui ne s’est pas encore déclarée au niveau structurel. Ces patients ablatés sur cœur apparemment sain doivent poursuivre un suivi régulier auprès de leur cardiologue traitant.
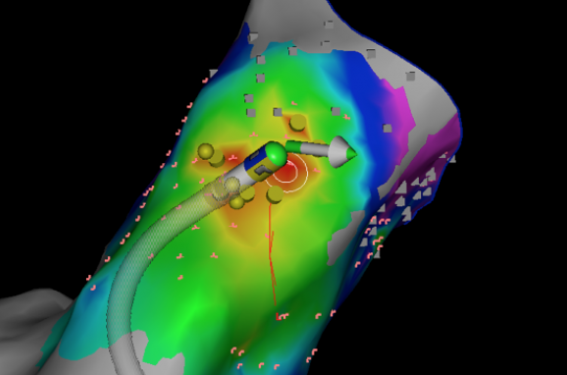
Figure 3. Ablation ESV infundibulaire du patient #1, avec système Biosense Webster Carto 3, à l’aide d’un cathéter « contact » (16 grammes sont appliqués à cet instant…). La zone rouge est la région où l’activation du myocarde est la plus précoce lors de l’ESV. Une autre technique dite de « pacemapping » consiste à stimuler à partir du cathéter pour voir si la morphologie en ce point reproduit exactement la morphologie de l’ESV cible (ici 97 % de concordance).
"Cardiologie Pratique : publication avancée en ligne".
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :