Rythmologie et rythmo interventionnelle
Publié le 20 mar 2007Lecture 11 min
IIes Journées de rythmologie des Arcs : la resynchronisation au cœur du débat
B. CHEVALIER, CHU de Lyon
Les objectifs de cette seconde réunion de rythmologie des Arcs étaient de réunir des experts des domaines différents, d’exiger d’eux le grand écart entre leurs disciplines respectives et d’échanger des idées dans les secteurs de la recherche fondamentale et de la clinique. Cette démarche, dans le cadre dynamisant des Alpes, nous a permis d’aborder l’insuffisance cardiaque sous un angle très large, avec des allers-retours du laboratoire au lit du patient, pour le plus grand bien de ce dernier.
La resynchronisation continue à susciter bien des questions.
Le traitement de resynchronisation biventriculaire est une thérapeutique bien établie des patients avec insuffisance cardiaque. Bien que l’utilisant quotidiennement, nous restons confrontés à de multiples questions :
• Pourquoi seulement 30 % des patients sont-ils répondeurs ?
• Quelle est la place de l’imagerie dans la sélection des patients ?
• Faut-il resynchroniser les patients avec complexes QRS fins ?
• Faut-il associer une fonction de défibrillation ?
Un traitement médical bien conduit est le pilier de la prise en charge du patient avec dysfonction ventriculaire gauche et la stimulation ne le remplace en aucun cas. La resynchronisation biventriculaire doit permettre d’optimiser la prise en charge médicamenteuse avec comme objectifs l’amélioration la qualité de vie et l’augmentation de l’espérance de vie.
Identification des patients répondeurs à la resynchronisation
D’après R. Itti, P. Chevalier et O. Piot
Définition du patient répondeur
L’identification du patient répondeur passe par l’évaluation de l’amélioration fonctionnelle (posologie du traitement diurétique, capacité d’effort…). Il faut aussi s’assurer que la thérapeutique de resynchronisation est bien délivrée avec la présence d’un affinement des QRS et d’un retard droit, et une capture biventriculaire complète. Au bout de six mois à un an, une diminution du volume ventriculaire gauche et éventuellement une diminution de la régurgitation mitrale seront recherchés.
La première cause de non-réponse tient à des problèmes d’accessibilité du territoire myocardique le plus tardivement activé. La viabilité de cette zone cible est aussi importante pour l’obtention d’un bénéfice hémodynamique. Enfin, quelle que soit la zone stimulée, un néo-asynchronisme défavorable peut survenir.
Les critères électrocliniques
Trente pour cent des patients ne répondent pas favorablement à la thérapeutique de resynchronisation. Les outils à notre disposition pour éviter des gestes inutiles sont imparfaits. Il s’agit avant tout de l’électrocardiogramme, de l’échocardiographie et de la scintigraphie. Actuellement, l’électrocardiogramme représente la base de la sélection des patients. Les patients avec des complexes QRS larges > 120 ms (avec un retard gauche et un rythme sinusal) sont ceux chez qui la thérapeutique électrique apporte le plus de bénéfice.
La réponse favorable hémodynamique est d’autant plus forte que les complexes QRS sont larges. À l’évidence, la dysfonction ventriculaire gauche doit être franche avec une fraction d’éjection mesurée à plusieurs reprises, < 35 %. Le handicap fonctionnel doit être franc, de classe III ou IV, malgré le traitement médical optimal.
Les critères échocardiographiques
En pratique, les critères d’asynchronisme atrio-, inter- et intraventriculaires sont simples à rechercher par tout cardiologue ayant un minimum de connaissances échographiques. Les modes Doppler, BD et TM permettent d’identifier 3 types d’asynchronisme qui ne seront pas repris ici car déjà détaillés dans d’autres numéros de Cardiologie Pratique.
Les critères scintigraphiques
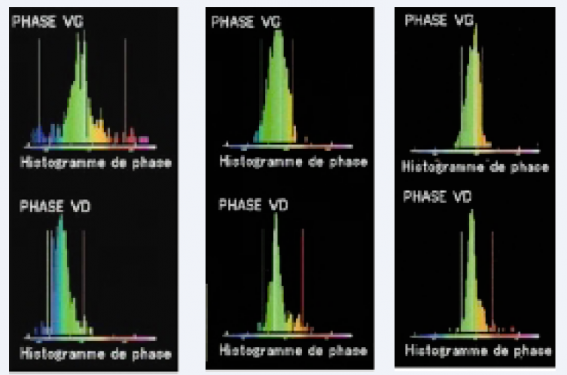
R. Itti a présenté la place des critères scintigraphiques dans l’indication de la resynchronisation. Les deux paramètres issus de l’analyse scintigraphique sont l’amplitude de contraction et la phase (figure 1). Ce dernier indice permet de savoir quelles parties du cœur se contractent et à quel moment. Une étude prospective lyonnaise réalisée sur 76 patients appareillés a démontré l’utilité de certains indices scintigraphiques pour identifier les patients répondeurs. À titre d’exemple, une différence de phase, entre les deux ventricules, > 20 %, permet la distinction entre répondeurs et non-répondeurs.
Figure 1. Un exemple de réduction franche de dispersion de phase lors de scintigraphies itératives chez un patient avec resynchronisation biventriculaire (R. Itti).
Les perspectives
Les études prospectives DESIRE et PROSPECT sont en cours pour établlir des nouveaux critères de sélection des patients. L’étude REVERSE débutée l’an dernier a pour but de valider ou non la resynchronisation chez les patients en stade II de NYHA, avec dysfonction ventriculaire gauche sévère et des QRS larges. L’utilité de la thérapeutique électrique dans le cadre de dysfonction diastolique reste aussi à prouver.
L’imagerie intégrée en temps réel, en offrant des informations à la fois mécaniques, anatomiques et électriques, pourrait dans un avenir proche nous aider à mieux traiter l’insuffisance contractile ventriculaire gauche.
Aspects techniques de la resynchronisation
D’après P. Chevalier, J.-L. Pasquie, O. Jegaden, J. Laborderie, A. Duprac et A. Lazarus
L’implantation épicardique endovasculaire
L’implantation épicardique endovasculaire de la sonde ventriculaire gauche est la technique la plus utilisée. Elle nécessite un environnement médico-technique optimal. Pour pallier les variations anatomiques très nombreuses du réseau veineux, l’opérateur aura le souci de disposer du maximum de types de sondes. La première étape est la canulation du sinus coronaire qui peut être rendue difficile par la présence de la valve de Vieussens. Une angiographie veineuse permettra ensuite d’identifier la présence ou non d’une veine cible avec une préférence pour les veines latérales et postérolatérales. Souvent, la sonde doit être glissée sur un guide métallique fin. Le type de sonde sera choisi en fonction du calibre de la veine. Elle sera laissée en place, en l’absence de stimulation phrénique et avec un seuil de stimulation < 4 volts. La dernière étape, l’extraction de la gaine porteuse, peut être délicate et exige beaucoup d’attention.
La stimulation épicardique par voie chirurgicale
La stimulation épicardique par voie chirurgicale a été présentée par O. Jegaden (Lyon) (figure 2). Cette technique, proposée en cas d’échec de l’approche endovasculaire, peut être réalisée après thoracotomie latérale ou par vidéothoracoscopie. Elle requiert une anesthésie générale après intubation sélective et décubitus dorsal latéralisé de 30° à droite avec une implantation sous-clavière gauche du boîtier. Le chirurgien effectue un abord latéral gauche dans le quatrième espace intercostal. Après ouverture du péricarde, il visse une électrode directement sur l’épicarde. À Lyon, la chirurgie robotique est aussi régulièrement pratiquée et permet une implantation en moins d’une heure, avec un bon positionnement épicardique de la sonde. Dans la majorité des cas, quelle que soit la technique, l’implantation chirurgicale de sondes-électrodes est un moyen simple, rapide et fiable de resynchronisation.
Figure 2. Implantation épicardique chirurgicale : l’exemple de la chirurgie robotique (O. Jegaden).
La stimulation endocardique ventriculaire gauche
La stimulation endocardique ventriculaire gauche est rarement utilisée.
Pour J.-L. Pasquie (Montpellier), cette approche a l’avantage d’être indépendante de l’anatomie veineuse et d’offrir une activation « plus physiologique » que le pacing épicardique.
Les seuils de stimulation sont aussi plus bas. La procédure est actuellement réalisée sous anesthésie générale après cathétérisme jugulaire transseptal, aidé par échographie transœsophagienne. À Montpellier, 6 patients ont déjà bénéficié de cette technique (figure 3).
Figure 3. Les étapes de l’implantation endocardique d’une sonde ventriculaire gauche (J.-L. Pasquier).
À long terme, une anticoagulation par antivitamines K est nécessaire avec un INR cible entre 2 et 3. La largeur des QRS a été abaissée de 184 ± 22 ms à 108 ± 11 ms. Tous les patients ont été améliorés avec une classe II obtenue dans le premier mois. La fraction d’éjection ventriculaire gauche a augmenté de 14 ± 7 %. Un patient a été repris en raison d’un déplacement de sonde ventriculaire gauche à trois mois. Cette technique apparaît donc particulièrement efficace et présente une alternative au pacing épicardique. Des études comparatives entre ces deux techniques sont nécessaires.
Complications de l’implantation
Les complications de la technique de resynchronisation ont été abordées par A. Duparc (Toulouse). Dans une métaanalyse (Leon et al., JACC 2005) réalisée à partir de 2 118 patients, le taux de complications est évalué à 24 % et le taux de mortalité liée à l’implantation à 0,30 %. En dehors des complications communes à toute implantation de pacemaker (hémothorax, pneumothorax, occlusion veineuse…) on note la dissection et la perforation du sinus coronaire. Cette complication est habituellement bien tolérée et peut être prévenue en évitant un matériel trop rigide ou en faisant progresser la gaine sur guide. La stimulation phrénique est rare et impose le repositionnement de sonde. Le déplacement de sonde survient dans 3 à 6 % des cas. Enfin, l’insuffisance rénale aiguë est toujours possible en raison de l’utilisation de produit de contraste chez des patients, insuffisants cardiaques et souvent âgés, traités par IEC.
Technique d’extraction de sonde
Le stimuliste doit maîtriser les techniques d’extraction nécessaires à l’extraction du matériel de stimulation. L’indication essentielle est l’infection du système. J. Laborderie (Bayonne) a bien montré pourquoi l’explantation était difficile avec la fibrose adhésive qui se développe entre les sondes et l’endocarde. Les techniques d’extraction à notre disposition sont la simple traction lente et douce avec mouvements de rotation, les sondes lasso et le laser. La première étape est la libération des attaches proximales. La libération des extrémités distales se fait plus difficilement, avec mandrin bloqueur fixé à l’extrémité de la sonde. Une fois cette extrémité distale libérée, une traction par voie fémorale est possible (matériel de Cook). La technique de contretraction par voie sous-clavière est de moins en moins réalisée. L’extraction laser avec gaine téléscopique qui est glissée sur la sonde peut s’avérer intéressante, en particulier lors d’extraction de systèmes très anciens. Cette technique d’extraction est toujours périlleuse et s’accompagne d’un taux de décès évalué entre 0,2 et 2,4 %. Les facteurs prédictifs de complication sont l’absence d’infection, le sexe féminin, et l’expérience de l’opérateur (moins de 50 procédures), ainsi que le nombre de sondes.
Controverses
D’après Ph. Ricard, J.-S. Hermida, E. Villain, A. Bozio, S. Kacet et Ph. Chevalier
L’optimisation de la resynchronisation biventriculaire doit-elle être systématique ?
Pour J.-S. Hermida (Amiens), régler les délais AV et VV pour obtenir le débit cardiaque le plus élevé possible n’est pas un bon objectif. Il souligne ainsi l’effet défavorable sur le long terme de l’augmentation de la contractilité, avec épuisement ventriculaire gauche. Il propose donc de limiter le réglage échocardiographique aux patients non répondeurs. Pour P. Ricard (Monaco), l’optimisation pour tous les patients appareillés de la resynchronisation par échographie « sur mesure » est indispensable. Il cite plusieurs essais qui ont démontré que le réglage de l’intervalle VV améliore de façon significative la symptomatologie des patients, de même que la programmation du délai AV.
En conclusion, les deux intervenants s’accordent sur le fait que dans la plupart des cas, le procédé d’optimisation par échocardiographie, bien que prenant beaucoup de temps, peut être utile. Le Doppler tissulaire n’a pas sa place dans cette démarche. Des algorithmes d’optimisation automatique du délai AV et VV sont disponibles mais leur validation reste encore incomplète.
La resynchronisation est-elle indiquée chez l’enfant avec insuffisance cardiaque ?
E. Vilain et A. Bozio ont échangé leurs points de vue sur l’intérêt de la resynchronisation chez l’enfant. Ils ont reconnu tous les deux l’importance de l’effet délétère de l’asynchronisme, notamment en cas de cardiopathie congénitale. Une seule étude, avec un petit nombre de patients, a fait état de l’expérience des cardiopédiatres dans ce domaine. Le taux de complications reste élevé et l’indication doit faire l’objet d’une discussion multidisciplinaire.
L’hétérogénéité de la population pédiatrique avec insuffisance cardiaque est aussi un obstacle à l’évaluation de la resynchronisation chez l’enfant.
Faut-il associer un défibrillateurà la resynchronisation ?
S. Kacet (Lille) défend l’idée qu’un défibrillateur doit être systématiquement associé à la thérapeutique de resynchronisation (figure 4). Il rappelle, à l’appui des études AVID et CASH, qu’en prévention secondaire, l’adjonction d’une défibrillation au système de stimulation est utile et augmente l’espérance de vie des patients implantés. En prévention primaire, l’étude SCD-HeFT a mis en évidence une diminution de la mortalité totale avec le défibrillateur par rapport à l’amiodarone ou l’absence de traitement chez les patients avec FEVG < 35 %.
Figure 4. Association défibrillateur et resynchronisation : l’expérience du CHU de Lille (S. Kacet).
P. Chevalier (Lyon) insiste sur le fait que la mort subite d’origine électrique est d’autant moins fréquente que la dysfonction ventriculaire gauche est sévère. Les patients en stade III ou IV de la NYHA décèdent plus souvent d’asystolie que de fibrillation ventriculaire. Par ailleurs si, selon l’étude COMPANION, on ne tient compte que du critère de jugement principal, le défibrillateur n’a pas fait ses preuves. De même, dans l’étude SCD-HeFT, la population d’étude ne ressemble pas à celle chez qui la resynchronisation est bénéfique (QRS peu élargis). Enfin, la resynchronisation seule sans défibrillation a un effet antiarythmique en favorisant le remodelage ventriculaire gauche.
En pratique, on retiendra que si l’indication de défibrillation associée à la resynchronisation en prophylaxie secondaire ne fait aucun doute, en prévention primaire les opinions divergent.
Le bénéfice du défibrillateur semble dans ce cas modeste et les recommandations ne sont que de classe II. D’autres études sont nécessaires pour identifier le risque rythmique chez les patients en classe III ou IV de NYHA.
Réglage du pacemaker
D’après P. Bordachar, D. Klug et C. Kouakam
Une implantation techniquement réussie ne dispense pas d’un ajustement des paramètres électriques. Cette programmation est réalisée avant la sortie de l’hôpital mais aussi régulièrement répétée selon l’évolution de la cardiopathie. Des études sont nécessaires pour définir la périodicité des programmations.
P. Bordachar (Bordeaux) a présenté les avantages et la technique de réglage du délai AV. Il rappelle que 20 à 47 % des patients en insuffisance cardiaque ont un allongement de l’intervalle PR, et que la correction de cet asynchronisme atrio-ventriculaire est fondamentale pour garantir un bon résultat de la resynchronisation.
L’échocardiographie Doppler est l’outil de référence pour améliorer le temps de remplissage ventriculaire gauche et garantir une capture ventriculaire complète. Un des moyens les plus simples est d’obtenir l’intervalle AV le plus long sans onde A tronquée et sans changer le profil Doppler transmitral. La formule de Ritter n’a pas été validée chez les patients avec resynchronisation.
D. Klug (Lille) a abordé le problème du réglage du délai VV. De nombreuses études ont suggéré que la programmation individualisée, pour chaque patient, du délai interventriculaire est importante. Le délai VV influe sur la qualité du remplissage ventriculaire gauche et l’éjection aortique. Des études randomisées restent cependant nécessaires pour quantifier ces bénéfices.
C. Kouakam (Lille) a terminé les sessions en évoquant les algorithmes de captures ventriculaires permanentes. L’absence de capture ventriculaire complète peut expliquer jusqu’à 10 % des échecs de la resynchronisation. L’objectif du stimuliste est donc d’assurer une stimulation quasi permanente des ventricules. Il semble, en effet, acquis que la stimulation ventriculaire droite apicale aggrave les dysfonctions VG préexistantes. En cas de fibrillation atriale, il est habituellement conseillé de procéder à une ablation de la jonction atrioventriculaire. Certains algorithmes (Trigger biventriculaire) permettent d’établir une « re-resynchronisation » par stimulation des deux ventricules après la détection d’une activité ventriculaire droite spontanée. Cet outil peut être utilisé en cas de fibrillation atriale si l’ablation n’est pas choisie.
L'essentiel
La resynchronisation ne dispense pas du traitement médicamenteux.
La resynchronisation n’est réservée qu’à certains patients. La largeur des intervalles QRS (> 120 ms) avec retard gauche est le meilleur critère de sélection.
La stimulation ventriculaire droite apicale est délétère en cas de dysfonction ventriculaire gauche préexistante.
À l’aide de mesures simples en mode TM et BD, l’échocardiographie est utile pour une optimisation « sur mesure ». L’utilité du Doppler tissulaire reste à démontrer.
Un plateau médico-technique et chirurgical complet conditionne le succès des implantations et la bonne gestion des complications.
Le défibrillateur n’est pas systématiquement associé à la resynchronisation.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :