Coronaires
Publié le 02 oct 2007Lecture 8 min
Infarctus du myocarde par embolie gazeuse coronaire lors d'une coelioscopie diagnostique : à propos d'un cas
A. El FADILI et coll* CHU IBN SINA, Rabat, Maroc
L’embolie gazeuse est une complication rare mais potentiellement létale de la chirurgie cœlioscopique(1,2,3,4). Le diagnostic formel peut être porté devant l’aspiration de gaz dans les cavités cardiaques droites ou la visualisation directe de bulles de gaz soit au cours d’une thoracotomie de sauvetage, soit lors d’une vérification anatomique post mortem(5,6). De ce fait, son incidence n’est pas précisément connue. Nous rapportons l’observation d’un infarctus du myocarde survenu au cours d’une cœlioscopie abdominopelvienne, et dont l’imputabilité à une embolie gazeuse coronaire est hautement probable.
Observation
Mme I. R. âgée de 38 ans, mère d’un enfant de 11 ans, sans facteurs de risque cardiovasculaire ni antécédent pathologique notable devait subir une cœlioscopie sous anesthésie générale dans le cadre du bilan étiologique d’une stérilité secondaire.
L’insufflation péritonéale a été effectuée jusqu’à une pression intra-abdominale de 12 cmH2O. Après l’insufflation du CO2, un collapsus est apparu ainsi que des troubles du rythme cardiaque à type d’extrasystoles ventriculaires puis une tachycardie ventriculaire suivie de l’apparition d’un sus-décalage du segment ST. Le capnographe a montré une chute brutale de la PET CO2 (pression télé-expiratoire de CO2) de 40 à 6 mmHg.
Le diagnostic d’embolie gazeuse a été évoqué et l’acte opératoire arrêté. L’exsufflation du pneumopéritoine et la mise en position de Trendelenburg associées à des manœuvres de réanimation ont été rapidement entreprises. Une échocardiographie transthoracique (ETT) réalisée aussitôt a révélé un aspect de contraste au niveau des cavités droites ainsi qu’une communication interauriculaire. Après pose d’un cathéter central par voie jugulaire interne atteignant l’oreillette droite, des bulles de gaz ont pu être retirées par aspiration, permettant une amélioration de l’état hémodynamique et de l’aspect échocardiographique.
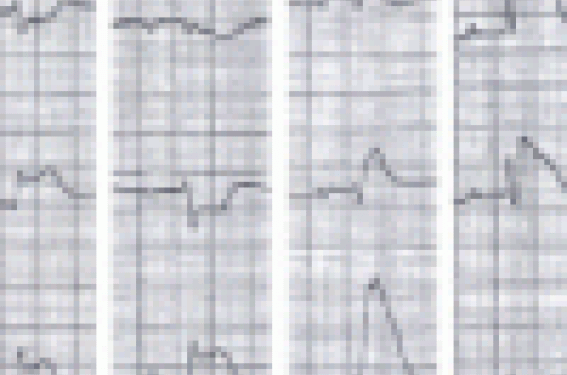
L’électrocardiogramme réalisé après la sortie du bloc a révélé un sus-décalage du segment ST et une ischémie sous-endocardique en antéro-septo-apical et en postéro-inférieur avec une image en miroir dans le territoire latéral (figure 1). Le dosage de la troponine fait une heure après l’incident est normal. Le remplissage vasculaire et la ventilation artificielle en oxygène à 100 % ont été poursuivis jusqu’au lendemain sous sédation au midazolam. Le traitement comportait de la dobutamine 10 g/kg/min à la seringue électrique + BPM + bêtabloquant + aspirine + IEC + patch dérivé nitré.
Figure 1. ECG effectué 30 min après l’accident : lésion sous-épicardique et ischémie sous-endocardiaque en antéro-septo-apical et postéro-inférieur avec une image en miroir dans le territoire latéral.
À son réveil, la patiente présentait un déficit hémicorporel droit qui a régressé spontanément. Un contrôle du bilan enzymatique au 3e jour a montré un titre élevé de la troponine à 21 ng/ml, des transaminases à 1,5 fois la normale et des LDH à 2 fois la normale. L’électrocardiogramme montrait alors une onde Q de nécrose avec une ischémie sous-épicardique dans le territoire septal profond. Une altération de la cinétique segmentaire dans le territoire antéro-septo-apical avec déformation de la pointe ainsi que la communication auriculaire ont été mises en évidence par une échocardiographie transthoracique réalisée 6 jours plus tard (figures 2, 3 et 4). À la coronarographie, le réseau coronaire paraissait lisse sans irrégularités athéromateuses (figures 5 et 6) avec, à la ventriculographie, un anévrisme apical sans altération de la fonction systolique du ventricule gauche (figure 7).
Les suites ont été simples et la malade est sortie sous traitement médical associant un IEC, un bêtabloquant, un antiagrégant plaquettaire et un anticoagulant.
Figure 2. ETT en coupe apicale des 4 cavités : déformation systolique de la pointe du ventricule gauche.
Figure 3. ETT par voie sous-costale : visualisation d’une communication interauriculaire (CIA).
Figure 4. ETT par voie sous-costale : shunt à travers la CIA au Doppler couleur.
Figure 5. Coronarographie du réseau gauche en incidence oblique antérieur droit (OAD) : aspect angiographique normal du tronc commun gauche, de l’artère interventriculaire antérieure, de l’artère circonflexe et de leurs branches.
Figure 6. Coronarographie du réseau droit en incidence oblique antérieur gauche craniale : artère coronaire droite dominante d’aspect lisse.
Figure 7. Ventriculographie en OAD : dyskinésie avec anévrisme apical. Le reste des parois sont de contractilité conservée. La fraction d’éjection est estimée à 62 %.
Discussion
La fréquence des complications hémodynamiques et/ou rythmiques sévères au cours de la chirurgie cœlioscopique abdominopelvienne n’est pas bien connue. L’incidence des embolies veineuses est sous-estimée, la plupart n’ayant pas, ou peu, de traduction clinique, hormis en période peropératoire où le diagnostic est facilité par la pratique systématique de la capnographie. Les décès ou arrêts cardiaques réversibles attribués à une embolie gazeuse sont exceptionnels(7,8,9). Leur gravité tient au volume de l’embole gazeux et à son débit. La disparition des bulles de gaz se fait par diffusion vers les alvéoles, mais la capacité d’épuration pulmonaire est limitée. Une observation publiée récemment a déterminé qu’une embolie gazeuse de 3 ml/kg-1 est létale chez l’homme. L’embolie gazeuse peut avoir une symptomatologie cardiaque variée : tachycardie, cœur pulmonaire aigu, collapsus, troubles du rythme divers, arrêt circulatoire, et troubles de la repolarisation évoquant une ischémie aiguë coronarienne(1-4,10,11).
Le pneumopéritoine
Le dioxyde de carbone (CO2) actuellement utilisé pour créer le pneumopéritoine peut pénétrer dans le système vasculaire par divers mécanismes(3,5,6). L’injection directe accidentelle dans un vaisseau représente une porte d’entrée incontestable. Le passage du gaz à travers une lésion veineuse chirurgicale ou barotraumatique lorsque la pression intra-abdominale dépasse la pression veineuse centrale est un deuxième mécanisme d’embolie gazeuse(8-10,12). Les localisations habituellement symptomatiques et potentiellement létales sont les cavités cardiaques avec désamorçage de la pompe cardiaque et le système vasculaire cérébral. La localisation coronaire est reconnue en chirurgie cardiaque ou lors de procédures de cardiologie interventionnelle, comme la coronarographie et l’angioplastie transluminale ; la pénétration du gaz est alors directe. Une embolie paradoxale est également possible en cas de persistance ou de réouverture d’un foramen ovale.
L’atteinte coronaire peut être en rapport avec deux mécanismes
L’ischémie directe par migration de bulles dans les vaisseaux coronaires ou fonctionnelle, secondaire à une augmentation brutale de la postcharge des cavités droites. Le passage de bulles dans la circulation systémique et notamment coronaire et/ou cérébrale peut se faire par diverses voies. L’embolie gazeuse paradoxale nécessite la persistance ou la réouverture d’un shunt droit-gauche et un gradient de pression favorable. Dans les conditions habituelles, les pressions élevées de l’oreillette gauche gardent la valve de la fosse ovale au contact du limbe et il n’existe pas de shunt gauche-droit significatif. Ce dernier se voit en présence d’un gradient de pression droit-gauche. L’augmentation des pressions dans les cavités droites en peropératoire peut être induite par la ventilation mécanique(13), par le pneumopéritoine, et éventuellement par l’obstruction de la circulation pulmonaire par l’embolie gazeuse elle-même. D’autres mécanismes de passage sans anomalies intracardiaques ont été proposés : passage d’un embole gazeux à travers le filtre capillaire pulmonaire, soit directement, soit par le biais de shunts artérioveineux pulmonaires(13-17). Des signes électriques de souffrance coronarienne doivent faire évoquer la possibilité d’une embolie gazeuse dans le réseau vasculaire coronaire. La capnographie est le moyen diagnostique le plus simple tout en étant sensible. Le capnographe a de plus l’avantage d’être muni d’une alarme qui, placée 2 à 3 mmHg au-dessous de la PETCO2, permet de reconnaître rapidement une baisse de la PETCO2. L’échocardiographie transthoracique et surtout transœsophagienne sont très intéressantes à la fois pour la détection d’une embolie gazeuse dans les cavités droites et la recherche d’un shunt droit-gauche(11,14,16).
Quel traitement ?
Le traitement d’une embolie gazeuse survenant pendant la chirurgie cœlioscopique associe la ventilation en oxygène pur, l’exsufflation du pneumopéritoine et la mise en décubitus latéral gauche éventuellement associée à la position de Trendelenburg. L’aspiration de gaz piégé dans les cavités droites par l’intermédiaire d’un cathéter veineux central déjà en place ou rapidement introduit mérite d’être tentée(1,4,5,13). Celui-ci doit être de gros calibre, multiperforé, permettant une aspiration importante d’air(18) ; son extrémité doit se situer 2 cm au-dessous de la jonction entre la veine cave supérieure et l’oreillette(19). Le recours en extrême urgence à une technique d’assistance circulatoire extracorporelle peut être un geste salvateur en cas d’arrêt cardiocirculatoire.
Dans notre observation
L’embolie gazeuse coronaire a été suspectée en peropératoire devant l’apparition d’un collapsus, d’une chute de la PETCO2, et de l’apparition du sus-décalage du segment ST et l’extrasystolie ventriculaire sur le scope. Il a été fortement évoqué à l’échocardiographie montrant l’existence de bulles de gaz en intracardiaque et la communication interauriculaire. L’aspiration de bulles de l’oreillette droite par l’intermédiaire d’un cathéter central a confirmé l’embolie gazeuse. Le diagnostic de l’infarctus du myocarde a été posé devant les modifications de l’électrocardiogramme, le mouvement enzymatique et les troubles de la contraction segmentaire du ventricule gauche à l’ETT. La fonction ventriculaire gauche est cependant restée conservée. Le résultat de la coronarographie soulève la notion de nécrose myocardique sur des artères coronaires anatomiquement normales. L’hypothèse d’un thrombus coronaire lysé spontanément est possible. Mais la présence de gaz au niveau des cavités cardiaques fait prévaloir l’embolie coronaire gazeuse comme responsable du tableau clinique. L’issue de bulles de gaz dans les artères coronaires dans ce cas est secondaire à l’injection directe de CO2 dans une veine abdominale et au passage de ces bulles dans les cavités cardiaques gauches puis dans les coronaires au travers la communication interauriculaire.
Par ailleurs, la patiente a également présenté un accident vasculaire cérébral probablement par le même mécanisme, spontanément régressif.
Conclusion
L’infarctus du myocarde par embolie gazeuse au cours de la chirurgie cœlioscopique est un accident rare mais potentiellement mortel. La prévention de ces accidents passe par une grande prudence pendant l’insufflation qui doit se faire par de faibles volumes sous faible pression, le monitorage de la PETCO2, et l’arrêt de l’insufflation en cas d’augmentation ou de diminution anormale de PETCO2.
Dans notre cas, cette complication est due à une embolie paradoxale à travers une communication interauriculaire restée jusque-là asymptomatique. Il convient de signaler que, pour notre malade, la fonction ventriculaire gauche est restée conservée malgré l’anévrysme apical. Toutefois, cela ne permet en aucune façon de se prononcer sur la survenue ou non de troubles du rythme cardiaque.
* Article écrit en collaboration avec R. CHERRADI, B. BABOU, N. ETTALIBI, H. FETTOUHI, A. TAMDY, B. FELLAT, L. OUKERRAJ, N. DOGHMI ET M. ARHARBI.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :