Thérapeutique
Publié le 19 sep 2006Lecture 9 min
Insuffisance cardiaque et anémie
P. DOS SANTOS, CHU de Bordeaux
L’insuffisance cardiaque chronique est une pathologie fréquente dont le pronostic reste sombre malgré les progrès récents réalisés dans les traitements médicamenteux, chirurgicaux ou par resynchronisation ventriculaire. Dans ce contexte, l’optimisation du traitement des facteurs de comorbidité s’avère cruciale. Des études récentes ont attiré l’attention sur la prévalence de l’anémie dans cette pathologie, qui semble particulièrement élevée. Des études pilote montrent que le traitement de l’anémie chez l’insuffisant cardiaque apporte des bénéfices en termes de morbidité et de mortalité. Cependant, sa prise en charge optimale requiert l’identification précise de ses causes, la meilleure compréhension des mécanismes par lesquels elle influe sur la progression de la maladie et la définition des stratégies de sa prise en charge.
Prévalence de l'anémie chez les insuffisants cardiaque
Dans la population générale l’anémie, selon les critères de l’Organisation mondiale de la santé (OMS), est définie par une concentration en hémoglobine < 13,0 g/dl chez l’homme et < 12 g/dl chez la femme. Cependant, il n’est pas clairement établi que cette définition conserve toute sa pertinence en cas de pathologie associée. Dans le cas des patients souffrant d’insuffisance cardiaque, chez lesquels la diminution du débit cardiaque est un facteur aggravant l’altération de l’oxygénation tissulaire induite par la diminution de l’hémoglobine, il n’y a pas de consensus sur les critères à prendre en compte pour définir l’anémie. Ainsi, les études et essais cliniques utilisent des critères variables, s’appuyant sur l’hématocrite ou la concentration en hémoglobine, pour discriminer les insuffisants cardiaques anémiques et non anémiques.
Cette absence de consensus est sans conteste la source majeure de l’énorme variabilité de la prévalence rapportée dans la littérature. À titre d’exemples, dans l’étude SOLVD (Study Of Left Ventricular Dysfunction) qui a étudié plus de 6 500 patients, la prévalence de l’anémie varie de 22 à 4,3 % selon que l’on retient comme critère diagnostique un hématocrite ≤ 39 ou < 35 %. Dans l’Euro Heart Failure Survey qui a étudié près de 10 000 patients, la prévalence de l’anémie varie de 18 à 33 % selon que l’on retient comme critère diagnostique une hémoglobine < 11 ou < 12 g/dl. Sur la base des critères de l’OMS, Horowich et coll. retrouvent, sur une cohorte de plus de 1 000 patients souffrant d’insuffisance cardiaque au stade III ou IV de la NYHA, une prévalence de l’anémie de 30 %. Ces auteurs rapportent aussi que l’hémoglobine est d’autant plus basse que la classe fonctionnelle est sévère, ce qui suggère que la prévalence de l’anémie augmente avec la gravité de la maladie (figure 1).
Figure 1. Relation entre la classe fonctionnelle NYHA et la concentration en hémoglobine chez les patients souffrant d'insuffisance cardiaque chronique.
Il apparaît donc que, en plus du critère retenu pour définir l’anémie, les caractéristiques de la population étudiée influent sur sa prévalence. Globalement, si l’on considère les résultats des principales études récentes rapportant la prévalence de l’anémie chez les insuffisants cardiaques, celle-ci varie de 9,9 % dans l’étude Val-HeFT (Valsartan Heart Failure Trial) (5 010 patients), où les critères retenus étaient une hémoglobine < 12 g/dl chez l’homme et < 11 g/dl chez la femme, à 55,6 % dans une étude de Silverberg et coll. (142 patients), où le critère retenu était une hémoglobine < 12 g/dl quel que soit le sexe.
Caractéristiques cliniques des insuffisants cardiaques anémiques
La caractérisation clinique des patients insuffisants cardiaques anémiques a été abordée dans plusieurs études. D’une manière générale, la population des insuffisants cardiaques anémiques se distingue de celle des non-anémiques par :
• un âge plus avancé (augmentation de la prévalence de 1 % en moyenne par année d’âge),
• des symptômes plus sévères,
• une plus grande fréquence des hospitalisations,
• des doses de diurétiques plus élevées,
• une plus grande proportion de femmes (augmentation de 20 % du risque d’anémie), de diabétiques, d’insuffisants rénaux (risque d’anémie multiplié par 3) et d’hypertendus (augmentation de 30 % du risque d’anémie),
• un poids corporel plus faible,
• des marqueurs biologiques d’inflammation.
Conséquences cliniques de l’anémie chez les insuffisants cardiaques
Sur les symptômes et les hospitalisations
Plusieurs études rapportent que les patients insuffisants cardiaques avec une anémie présentent des symptômes plus sévères que les non-anémiques. Cette observation est bien illustrée par la figure 2, tirée de l’étude de Horwich et coll., qui montre que la proportion de patients en classe IV de la NYHA augmente avec la diminution de la concentration en hémoglobine. Une étude de Kalra et coll. a exploré cette observation plus en détail en montrant qu’une concentration en hémoglobine < 13 g/dl est un facteur prédictif indépendant puissant de limitation de la capacité fonctionnelle à l’effort, alors qu’il n’y a pas de corrélation entre la consommation maximale en oxygène et l’hémoglobine pour des taux > 13 g/dl. L’existence d’une anémie est aussi étroitement associée au risque d’hospitalisation.
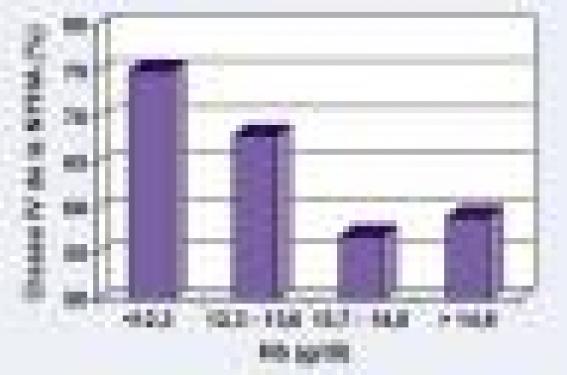
Figure 2. Relation entre la concentration en hémoglobine et la mortalité de toutes causes à 1 an chez les patients souffrant d'insuffisance cardiaque chronique (adapté des données du registre IN-CHF).
Sur la mortalité
Plusieurs études ont établi que l’anémie est un facteur de risque indépendant de mortalité chez l’insuffisant cardiaque, que l’augmentation de la mortalité semble liée de manière linéaire à la sévérité de l’anémie (augmentation de 2,7 % du risque de mortalité pour 1 % de réduction de l’hématocrite chez les patients de l’étude SOLVD), et que celle-ci est observée même dans le cas d’anémies modérées. Une étude de Mozaffarian et coll., comportant une analyse du risque de mortalité par quintiles, rapporte une augmentation de 52 % du risque de mortalité dans le groupe de patients ayant un hématocrite compris entre 25,4 et 37,5 % comparativement à celui ayant un hématocrite compris entre 46,1 et 58,8 %. Cette augmentation du risque de mortalité, qui paraît davantage liée à l’aggravation progressive de l’insuffisance cardiaque qu’à une augmentation de la mort subite ou d’autres causes, est deux fois plus élevée que celle liée à l’existence d’un diabète, d’un tabagisme, d’un âge de 10 années supérieur, ou d’une différence de 10 % de fraction d’éjection.
Mécanismes pathogéniques de l’anémie chez l’insuffisant cardiaque
Il est bien connu que l’anémie peut être la cause d’une insuffisance cardiaque. Elle peut aussi être sa conséquence. La pathogénie de l’anémie lors de l’insuffisance cardiaque est un problème complexe, multifactoriel, imparfaitement élucidé dans lequel l’érythropoïétine (EPO) paraît jouer un rôle central. Environ 60 % des anémies observées chez les insuffisants cardiaques n’ont pas de cause spécifique.
Anomalie de la production d’érythropoïétine
L’EPO est une hormone de croissance produite essentiellement par le rein, participant à la régulation de la masse de globules rouges et au maintien de l’oxygénation tissulaire. Elle est produite au niveau du cortex rénal en réponse à une diminution locale de la tension en oxygène.
Contrairement à ce qui est observé communément chez les patients souffrant d’anémie par maladie chronique, l’EPO est élevée proportionnellement à la sévérité des symptômes chez les insuffisants cardiaques. L’augmentation de la production d’EPO lors de l’insuffisance cardiaque est vraisemblablement liée à la baisse de la perfusion rénale et à l’augmentation de la réabsorption de sodium au niveau du tubule proximal, elle-même liée à l’activation du système rénine-angiotensine-aldostérone (figure 3). Bien que les niveaux d’EPO endogène soient généralement augmentés chez les insuffisants cardiaques, cette augmentation paraît faible au regard de ce qui serait requis pour compenser l’anémie de l’insuffisance cardiaque.
Figure 3. Proposition de mécanismes contribuant à l'anomalie de régulation de la production d'érythropoïétine (EPO) chez les patients souffrant d'insuffisance cardiaque chronique.
En conséquences, l’anémie observée chez certains insuffisants cardiaques peut être en partie attribuable à un défaut de production endogène d’EPO et pourrait donc répondre à un traitement par de l’EPO exogène.
Diverses anomalies associées à l’insuffisance cardiaque peuvent expliquer cette inadéquation de la production d’EPO en réponse à l’hypoxie tissulaire lors de l’insuffisance cardiaque. L’intrication des mécanismes régulant la concentration en hémoglobine, les modifications du volume plasmatique, les paramètres hémodynamiques et l’activation du système sympathique fait de l’insuffisance cardiaque une cause potentielle d’anémie qui va, en retour, aggraver la maladie (figure 4, cercle vicieux du syndrome de l’anémie cardio-rénale).
Figure 4. Représentation schématique du syndrome cardio-rénal-anémie dans lequel l'anémie est à la fois cause et conséquence d'insuffisance cardiaque.
L’insuffisance de production d’EPO peut aussi provenir de la surexpression de cytokines proinflammatoires, au premier rang desquelles figurent le TNF, l’interleukine 1 et l’interleukine 6. Il est possible aussi que ces cytokines induisent, en plus d’une altération de la production d’EPO, une résistance à ses effets périphériques. Enfin, le traitement par les inhibiteurs de l’enzyme de conversion (IEC) pourrait aussi perturber la synthèse d’EPO, directement ou par inhibition de l’hydrolyse de la N-acétyl-séryl, aspartyl-lysyl-proline (Ac-SDKP), un inhibiteur de l’hématopoïèse.
À ce titre, il est possible que les antagonistes des récepteurs de l’angiotensine 2, qui ont un effet moins prononcé sur les taux d’Ac-SDKP que les IEC, tirent une indication spécifique dans le traitement des insuffisants cardiaques anémiques.
Le déficit en fer
De multiples facteurs, et particulièrement la malnutrition, favorisent la carence en fer chez les insuffisants cardiaques. Une étude de Ezekowitz et coll. rapporte l’existence d’une carence martiale chez 21 % des insuffisants cardiaques. En effet, l’insuffisance cardiaque prédispose à la carence martiale par anomalies nutritionelles, malabsorption intestinale, traitement (parfois abusif) par l’aspirine, gastrite urémique, protéinurie. La malnutrition des insuffisants cardiaques peut aussi engendrer des carences en folates, et vitamine B12.
La carence martiale chez les insuffisants cardiaques serait d’environ 20 %.
L’inflammation
La surexpression des cytokines pro-inflammatoires lors de l’insuffisance cardiaque (interleukines 1 et 6, TNF) est susceptible de perturber l’érythropoïèse et d’engendrer une anémie, comme le montrent certains modèles expérimentaux d’insuffisance cardiaque. Une corrélation négative entre le TNF, les récepteurs solubles du TNF ou la CRP, d’une part, et la concentration en hémoglobine, d’autre part, a été montrée chez l’homme.
L’hémodilution
Enfin, l’anémie chez les insuffisants cardiaques peut être la conséquence de l’hémodilution secondaire à l’activation du système rénine-angiotensine-aldostérone et du système de la vasopressine qui engendre une réabsorption d’eau et de sel. À ce titre, l’association d’une anémie et d’une hémodilution est un facteur de très mauvais pronostic.
Traitement spécifique de l’anémie chez les insuffisants cardiaques
Faut-il traiter spécifiquement l’anémie des patients souffrant d’insuffisance cardiaque ? Si oui, comment ? Des études pilotes limitées suggèrent que le traitement de l’anémie par des combinaisons de fer et d’érythropoïétine permet d’améliorer les symptômes. Des études plus larges et prolongées sont nécessaires pour établir leurs effets à long terme et leur aptitude à diminuer la mortalité.
Les premiers essais utilisant un recombinant de l’érythropoïétine humaine (rHUEpo) ont été réalisés dans le cadre de l’insuffisance rénale terminale. Ils ont montré une diminution du développement de l’hypertrophie cardiaque et des effets bénéfiques sur le remodelage ventriculaire gauche, une amélioration des capacités fonctionnelles et parfois du pronostic vital. Ces études montrent cependant les risques (augmentation du risque d’infarctus) qu’il y a à atteindre des niveaux d’hématocrite « élevés » (> 42 %) et attirent l’attention sur la nécessité de définir avec précaution la valeur optimale de l’hémoglobine ou l’hématocrite cible. D’une manière générale, la valeur cible de l’hémoglobine dans ces essais se situait entre 12,5 et 13,5 g/dl.
Les premiers travaux de Silverberg et coll. portant sur 179 patients souffrant d’insuffisance cardiaque sévère et d’insuffisance rénale modérée avec anémie ont montré que le traitement par érythropoïétine et fer améliore la capacité fonctionelle, diminue les hospitalisations et améliore la fraction d’éjection. D’autres travaux de la même équipe, toujours non randomisés, portant sur une population limitée de patients sélectionnés sur la base d’une insuffisance cardiaque de classe NYHA III ou IV, et testant un traitement à base d’érythropoïétine + fer, montrent une amélioration de la classe fonctionnelle de la NYHA, de la fraction d’éjection (de 27,7 ± 4,8 % à 35,4 ± 7,6 %), une diminution de la dose de diurétiques et des hospitalisations.
De toute évidence, malgré des résultats encourageants, de plus larges études, randomisées, avec un suivi prolongé sont nécessaires afin d’établir définitivement la sécurité des stratégies de traitement de l'anémie et leur intérêt sur le pronostic de l’insuffisance cardiaque. Des études utilisant la darbépoétine-α, qui est un dérivé glycosylé de l’érythropoïétine à longue durée d’action, sont en cours.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :