Thérapeutique
Publié le 29 nov 2011Lecture 11 min
Les nouveaux anticoagulants actifs per os et d’action rapide - Une modification profonde des pratiques
D. MOTTIER, Hôpital de la Cavale Blanche, Brest

Les anticoagulants ont transformé le pronostic de la maladie thromboembolique artérielle et veineuse. Les molécules disponibles, déjà anciennes (héparine, antivitamine K, etc.) présentent cependant un ou plusieurs inconvénients qui compliquent la prise en charge des patients. Ces dernières années, les efforts ont porté sur le développement de molécules actives per os, d’action rapide, avec l’espoir qu’elles soient plus sûres, plus maniables, avec une faible variabilité interindividuelle, peu sensible aux interactions médicamenteuses et ne nécessitant pas de surveillance biologique. La place de ces molécules dans l’arsenal thérapeutique se précise avec les résultats des études dans le traitement de la maladie veineuse thromboembolique et dans la prise en charge de la fibrillation atriale. Les résultats de ces études sont positifs et permettent d’espérer le remplacement des anticoagulants injectables, en tout cas dans certaines populations, et surtout le remplacement des AVK.
Mécanisme d’action des nouveaux anticoagulants actifs per os et d’action rapide
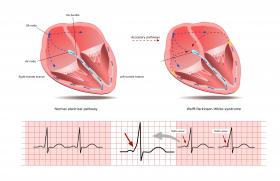
Il existe un équilibre très subtil entre systèmes coagulant et anticoagulant physiologiques (figure 1). Les anticoagulants disponibles rompent cet équilibre par deux mécanismes (figure 2) :
Amélioration des performances du système anticoagulant physiologique, ce sont les antithrombines cofacteur-dépendant. Il s’agit de l’héparine non fractionnée (HNF), l’activité anticoagulante est liée à l’activation de l’antithrombine, activation médiée par une séquence de 5 sucres (pentasaccharide). La prédictibilité de la réponse à l’héparine non fractionnée, aux doses curatives, est faible. Ceci impose une surveillance biologique étroite qui repose sur la mesure du temps de céphaline activée. Les héparines de bas poids moléculaire (HBPM), par rapport à l’HNF, ont une réponse anticoagulante très prédictible. Ceci autorise une dose calculée par rapport au poids en une ou deux injections, sans surveillance biologique.
L’identification et l’isolement de la structure active pentasaccharidique de l’héparine a permis la synthèse chimique du fondaparinux, qui reproduit cette séquence pentasaccharidique. Son effet anticoagulant est prédictible et il est donné à la même dose chez tous les patients entre 50 et 100 kg.
Figure 1. Systèmes coagulant et anticoagulant physiologiques.
Figure 2. Mécanismes d’action des nouveaux anticoagulants.
Le deuxième mécanisme d’action possible des anticoagulants est de diminuer les performances de la coagulation. Ceci peut se faire également de deux manières :
– En diminuant la synthèse des facteurs de la coagulation, c’est le mécanisme d’action des AVK qui déprime la synthèse des facteurs de la coagulation vitamine K dépendants (facteurs II, VII, IX et X). L’effet anticoagulant des AVK est obtenu via l’inhibition de la vitamine K époxyde réductase (VKORC1). Le gène de VKORC1 est soumis à des polymorphismes, dans la population générale, ces variations génétiques expliquent en partie les différences de sensibilité aux AVK. Les AVK se fixent à 97 % aux protéines. Ils sont métabolisés par le système des cytochromes hépatiques. Les variations pharmacocinétiques interindividuelles et intra-individuelles imposent une surveillance biologique faite par l’INR, qui est un mode standardisé d’expression du temps de Quick.
– En inhibant directement un facteur de la coagulation, ce sont les anti-IIa directs et les anti-Xa directs. C’est le mécanisme d’action des nouveaux anticoagulants. Le dabigatran est le seul à avoir une activité anti-IIa directe. Les autres ont une activité anti-Xa, avec plus d’une dizaine de molécules en cours de développement : rivaroxaban, apixaban, edoxaban, otamixaban… L’ensemble de ces médicaments a été développé sans surveillance biologique.
Contraintes et limites des anticoagulants actuels
Les anticoagulants d’action rapide actuels n’existent que par voie injectable, intraveineuse ou sous-cutanée (SC) pour l’HNF, une ou deux injections par jour en SC pour les HBPM, une injection SC par jour pour le fondaparinux. L’HNF peut être responsable de thrombopénies induites par l’héparine, d’ostéoporose, risque nettement moins important pour les HBPM, inexistant pour le fondaparinux.
En revanche, HBPM et fondaparinux sont éliminés préférentiellement par le rein et sont contre-indiqués formellement en curatif si la clairance de la créatinine par la formule de Cockcroft est inférieure à 30 ml/min.
Dans ces situations, seule l’HNF peut être utilisée. Les doses d’HNF utilisées sont fonction d’un test de coagulation (TCA), les doses d’HBPM sont fonction du poids, les doses de fondaparinux sont fixes, entre 50 et 100 kg. La surveillance biologique par les plaquettes reste nécessaire pour l’héparine non fractionnée, elle reste indiquée pour les HBPM en milieu chirurgical, mais pas en milieu médical, elle n’est pas nécessaire avec le fondaparinux. Enfin, il existe un antidote pour l’HNF, c’est le sulfate de protamine, antidote qui est moins efficace pour les HBPM, il n’y a pas d’antidote pour le fondaparinux.
Les limites d’utilisation des AVK sont nombreuses : en effet, l’action antithrombotique n’est observée qu’au bout de trois à six jours. Les antivitamines K n’ont pas d’action sur la thrombine activée. Pour ces deux raisons, les AVK n’ont pas de place à la phase aiguë de la thrombose. La deuxième difficulté est l’existence d’importantes variations intra- et interindividuelles de l’effet biologique des AVK, liées à des variations génétiques du métabolisme, à de nombreuses interactions médicamenteuses et à l’alimentation. La description récente d’une interaction médicamenteuse avec le paracétamol est venue compliquer la prise en charge de ces patients, en particulier s’ils sont fébriles ou douloureux. En effet, le paracétamol est responsable d’une potentialisation de l’effet anticoagulant des AVK par défaut de métabolisation à l’origine de surdosages et donc d’hémorragies, alors que pendant des décennies, la coprescription AVK-paracétamol était réputée anodine. L’index thérapeutique des AVK est étroit, avec un risque thrombotique si l’INR est inférieur à 2, un risque hémorragique rapidement croissant si l’INR est supérieur à 3. L’importance de l’équilibre du traitement est majeure pour éviter les récidives thrombotiques à l’occasion d’un sous-dosage, ou la survenue d’une hémorragie à l’occasion d’un surdosage. Or, les études récentes montrent qu’une hémorragie sur deux survient à l’occasion d’un surdosage et qu’une récidive thrombotique sur deux survient à l’occasion d’un sous-dosage. Une étude de l’AFSSAPS, en 2000, a montré qu’en pratique quotidienne, dans la « vraie vie », moins d’un malade sur deux est en zone thérapeutique lorsqu’on contrôle son INR.
Les caractéristiques d’un anticoagulant idéal peuvent être résumées de la façon suivante :
– actifs per os, d’action rapide, avec un effet rapidement réversible, permettant de remplacer à la fois les anticoagulants d’action rapide utilisés par voie injectable et les AVK ;
– avec une efficacité au moins comparable et une tolérance améliorée, ce qui paraît être un objectif raisonnable quand on voit les difficultés de prescription des AVK ;
– prescrits à dose fixe, sans contrôle biologique, sans interaction médicamenteuse ;
– à des posologies utilisables en traitement préventif et en traitement curatif ;
– efficaces à la fois sur la prévention des accidents thrombotiques sur le versant artériel et le versant veineux ;
– avec un antidote.
Les nouveaux anticoagulants se rapprochent-ils de l’anticoagulant idéal ?
Les nouveaux anticoagulants vont-ils remplacer les anticoagulants d’action rapide utilisables par voie injectable et les AVK ?
Les tableaux 1 et 2 apportent quelques réponses à la comparaison nouveaux anticoagulants versus anticoagulants d’action rapide utilisables par voie injectable et nouveaux anticoagulants versus AVK.
Les données des essais thérapeutiques de phase III publiées, dans la prévention de la maladie veineuse thromboembolique en chirurgie orthopédique majeure, dans le traitement de la maladie veineuse thrombo-embolique et dans la prise en charge de la fibrillation atriale, permettent de répondre partiellement aux questions posées.
• Les anticoagulants d’action rapide vont remplacer les anticoagulants d’action rapide injectables dans la prévention de la maladie veineuse thromboembolique en chirurgie orthopédique majeure (prothèse totale de genou ou de hanche). Le dabigatran et le rivaroxaban ont déjà obtenu l’AMM dans cette indication. Les nouveaux anticoagulants apparaissent au moins aussi efficaces et aussi bien tolérés que les HBPM dans cette indication. Pour le dabigatran, deux doses ont été évaluées, 150 et 220 mg une fois/jour, pour le rivaroxaban, 10 mg une fois/jour.
• Les nouveaux anticoagulants actifs per os et d’action rapide vont-ils remplacer les anticoagulants d’action rapide injectables dans la prise en charge initiale de la maladie veineuse thromboembolique constituée (thrombose veineuse profonde, embolie pulmonaire) ? Dans cette indication, les objectifs industriels sont très différents d’une molécule à l’autre. Ainsi, par exemple, le dabigatran, dans le traitement de la maladie veineuse thromboembolique, ne cherche pas à se substituer aux anticoagulants d’action rapide utilisés par voie injectable. Par contre, le rivaroxaban et l’apixaban, dans cette indication, ont pour objectif de remplacer à la fois les anticoagulants d’action rapide injectables et les antivitamines K.
• Les anticoagulants d’action rapide actifs per os vont-ils remplacer les antivitamines K dans le traitement prolongé de la maladie veineuse thromboembolique après la phase aiguë ? Toutes les molécules sont évaluées dans cette indication versus AVK. Les résultats des premiers essais (RE COVER pour le dabigatran, EINSTEIN TVP pour le rivaroxaban) montrent que ces médicaments sont au moins aussi efficaces, sans qu’il y ait un excès d’hémorragies.
• Les nouveaux anticoagulants actifs per os et d’action rapide vont-ils remplacer les AVK dans la prise en charge du risque thrombotique lié à la fibrillation auriculaire ? Trois essais thérapeutiques sont déjà publiés, ils concernent le dabigatran, le rivaroxaban et l’apixaban. Le dabigatran, dans l’étude RELY, a été évalué versus AVK en ouvert. Deux doses de dabigatran sont évaluées, 220 mg et 300 mg/jour, les patients et les médecins étaient en aveugle de la dose de dabigatran administrée. Les résultats de cette étude, qui a inclus 18 113 patients, montrent que le dabigatran à la dose de 220 mg est non inférieur sur le critère principal (accidents vasculaires cérébraux et embolies systémiques périphériques) par rapport à la warfarine, avec une diminution des hémorragies totales et des hémorragies majeures. Le dabigatran à la dose de 300 mg/jour est supérieur à la warfarine sur le même critère principal. Il n’y a pas de réduction significative des hémorragies majeures, mais une diminution des accidents vasculaires cérébraux hémorragiques et des hémorragies totales (p = 0,002).
Le rivaroxaban a été évalué en double aveugle dans l’étude ROCKET-FA versus warfarine, dans la prise en charge de la fibrillation auriculaire. Les patients recevaient soit 20 mg de rivaroxaban, soit 15 mg si la clairance était comprise entre 30 et 50 ml/min. On peut dire qu’il existe au moins une non-infériorité du rivaroxaban versus warfarine sur le même critère d’évaluation utilisé dans l’étude RELY. Dans cette étude, il n’y a pas de diminution du risque hémorragique global. En revanche, il existe, là aussi, une diminution très nette des hémorragies cérébrales. Ces deux premières études ne sont pas totalement comparables. En effet, l’étude qui a évalué le dabigatran est en ouvert, celle qui a évalué le rivaroxaban est en double aveugle. Deux doses ont été utilisées et évaluées pour le dabigatran chez tous les patients, deux doses différentes ont été utilisées avec le rivaroxaban, mais une dose forte à 20 mg lorsque la clairance était supérieure à 50 ml/min, une dose plus faible à 15 mg lorsque la clairance était inférieure à 50 ml/min. Enfin, les patients n’ont pas la même gravité dans les deux études. Le risque thrombotique des patients était plus important dans l’étude qui a évalué le rivaroxaban.
L’apixaban vient de faire la preuve de son efficacité dans la prévention des accidents thromboemboliques de la FA.
L’étude ARISTOTLE a inclus 18 201 patients en FA ayant eu au moins un facteur de risque additionnel d’AVC pour tester apixaban 5 mg, 2 fois par jour, comparativement à la warfarine avec un INR cible entre 2 et 3. Le score CHADS2 moyen était de 2,1. 20 % des patients avaient déjà fait un AVC, 35 % étaient en insuffisance cardiaque, 25 % diabétiques, 88 % hypertendus et 31 % étaient âgés ≥ 75 ans. En cas de deux critères, âge ≥ 80 ans, poids ≤ 60 kg, créatininémie ≥ 133 µmol, la posologie d’apixaban était réduite à 2,5 mg, 2 fois par jour.
L’apixaban permet une diminution significative de 21 % des AVC et embolies systémiques, une diminution des saignements majeurs de 31 % et notamment des accidents cérébraux hémorragiques. La mortalité totale est réduite de 11 %.
Après RELY et ROCKET-AF, l’apixaban est le 3e nouveau traitement anticoagulant oral à démontrer son efficacité dans la FA.
Ce qui est à souligner, c’est au moins la non-infériorité démontrée avec le rivaroxaban, voire la supériorité avec le dabigatran 150 mg et l’apixaban récemment, et associée à ces résultats, une diminution très nette du risque hémorragique cérébral, qui est l’hémorragie la plus préoccupante.
• Il n’y a pas encore d’étude disponible sur la prise en charge du syndrome coronarien aigu avec ces nouvelles molécules.
En définitive, ces nouvelles molécules remplissent-elles le cahier des charges de l’anticoagulant idéal tel que nous l’avons défini plus haut ?
La réponse doit être nuancée. En effet, les essais thérapeutiques ne nous permettent pas de répondre à l’efficacité et à la tolérance dans les populations les plus fragiles, c’est-à-dire chez les sujets âgés, voire très âgés, et chez le patient insuffisant rénal avec une clairance inférieure à 30 ml/min. S’il existe effectivement une rapidité d’action, l’effet n’est en revanche pas rapidement réversible et il est probable qu’il faille attendre au moins trois demi-vies pour voir diminuer de façon significative le risque hémorragique lié à un geste agressif sous ces médicaments (48 heures). Il n’y a pas d’antidote actuellement disponible. Des interactions médicamenteuses considérées comme significatives sont possibles avec les nouveaux anticoagulants oraux. Comme nous l’avons vu, tous les deux sont des substrats de la PGP, et le rivaroxaban est, de plus, un substrat des cytochromes P450 hépatiques. Ces deux protéines présentent d’importantes variations interindividuelles de leur activité, qui dépendent de facteurs génétiques et environnementaux, en particulier médicamenteux.
Quelles vont être les implications cliniques de ces interactions ? Il est trop tôt pour le dire, le nombre de patients exposés à ces interactions reste faible dans les essais thérapeutiques et la liste de médicaments interférant ou modifiant l’activité de la PGP et des cytochromes est importante. Les essais thérapeutiques ont montré qu’on pouvait utiliser ces médicaments sans contrôle biologique dans la population où ils ont été évalués. Cependant, lorsqu’un patient est sous ces molécules, il ne faut pas être surpris par les variations des tests de la coagulation s’ils sont demandés (INR, TCA, mesure des facteurs de la coagulation). Ces modifications peuvent survenir dès les posologies préventives. Dans les essais de phase III évaluant l’efficacité de ces médicaments, on n’a pas montré de corrélation entre l’intensité de la variation de ces tests biologiques et le risque thrombotique ou le risque hémorragique ; en tout cas, il n’y a jamais eu d’adaptation de doses en fonction de ces tests.
En pratique
Actuellement, on assiste à une véritable révolution thérapeutique avec le développement des nouveaux anticoagulants actifs per os et d’action rapide, qui permettent d’envisager, de façon raisonnable à terme, le remplacement des anticoagulants d’action rapide actifs par voie parentérale et surtout les antivitamines K dont on connaît les difficultés d’utilisation.
L’histoire du ximélagatran (Exanta) nous a appris la prudence. Cependant, les résultats des essais avec une utilisation déjà prolongée de ces anticoagulants, permettent un optimisme raisonnable ; la diversité des molécules en cours de développement est un argument supplémentaire. Révolution thérapeutique, parce que ce n’est pas simplement un changement de comprimé pour un autre comprimé, mais c’est une modification profonde des pratiques professionnelles grâce à ces nouvelles molécules, qui vont faciliter la prise en charge ambulatoire, faciliter la surveillance et peut-être permettre un élargissement des indications (durée de traitement, type de pathologies traitées).
La simplification de ces nouveaux traitements anticoagulants n’épargne pas les risques de mauvaise observance, de traitement sans diagnostic, de banalisation de la prescription et justifie une information et une éducation à la fois du milieu médical et des patients. Les premières années d’utilisation devront être suivies avec une particulière attention et le développement d’une pharmacovigilance active mettant sous surveillance des cohortes de patients.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :