Trucs et astuces
Publié le 25 oct 2019Lecture 11 min
Comment gérer une cartographie incohérente ?
Frédéric SACHER, Josselin DUCHATEAU, Bordeaux
Pour obtenir une carte cohérente, il est important de se rappeler que les systèmes de cartographie 3D ne font que traduire en couleur une analyse des signaux électriques enregistrés. Cet article passe en revue les étapes nécessaires à l’obtention d’une carte cohérente : qualité du signal, annotation par le système de cartographie et algorithme de reconstruction de l’activation.
Acquisition du signal
C’est la partie la plus importante pour obtenir une cartographie cohérente. Il faut garder en mémoire que tous les systèmes de cartographie sont intrinsèquement capables de produire une carte à partir de bruits, même sans aucun signal réel. Si les électrogrammes (EGM) enregistrés sont de mauvaise qualité, il sera impossible d’avoir une carte cohérente, et ce quel que soit le système utilisé.
Rapport signal/bruit
Il est indispensable d’avoir un laboratoire d’électrophysiologie bien isolé électriquement. Un appareil électrique proche (automates de biologie, congélateur, etc.), peut engendrer des interférences électro-magnétiques. Le bruit induit par des appareils externes est maximal sur les enregistrements unipolaires, souvent peu regardés, mais qui sont utilisés pour la construction des cartes d’activation de certains systèmes (cf. ci-après).
L’installation du patient est une étape cruciale parfois négligée. Le positionnement des électrodes de surface doit être optimisé (préparation cutanée, électrodes de qualité), en particulier celui des dérivations frontales, qui participent au calcul de toutes les dérivations ECG et de tous les endocavitaires unipolaires. Il faut avoir le moins d’appareils électriques possible autour du patient, et éviter de faire cheminer des câbles d’alimentation avec ceux dans lesquels transitent les signaux endocavitaires. Il faut éviter de croiser les câbles, et s’ils se croisent, privilégier des intersections à angle droit. Tous les appareils électriques sont au mieux reliés à une prise de terre commune. Les appareils qui peuvent fonctionner sur batterie doivent être débranchés des prises murales (pousse-seringue, tensiomètre, etc.). Il faut tout particulièrement faire attention à la pompe d’irrigation du cathéter, qui peut transmettre du bruit sur l’électrode distale du cathéter d’ablation.
Lorsqu’on a du bruit sur l’électrode distale du cathéter d’ablation, on peut essayer de stimuler pendant quelques secondes et souvent le bruit diminuera. Dans notre expérience, cela fait passer le bruit de 0,05 mV à 0,02 mV en moyenne. Les niveaux de bruit sont différents d’un laboratoire à l’autre mais on doit viser au maximum un niveau de bruit < 0,05 mV avec un cathéter d’ablation et < 0,02 mV avec un cathéter de cartographie. Cela est particulièrement important si l’on cible des arythmies survenant sur tissu cicatriciel (EGM bas voltés) (figure 1). À noter qu’on a la possibilité de définir une valeur « seuil » de bruit sur les systèmes de cartographie : « confidence mask » du Rhythmia, réglé par défaut à 0,02 mV, et « Bipolar Noise level » du CARTO, réglé par défaut à 0,03 mV. Cela signifie que tout signal avec une amplitude inférieure à ce seuil ne sera pas analysé. Si le seuil est trop bas, le système risque d’annoter du bruit comme signal et s’il est trop haut, l’opérateur risque au contraire de passer à côté d’informations potentiellement cruciales à la compréhension de l’arythmie.
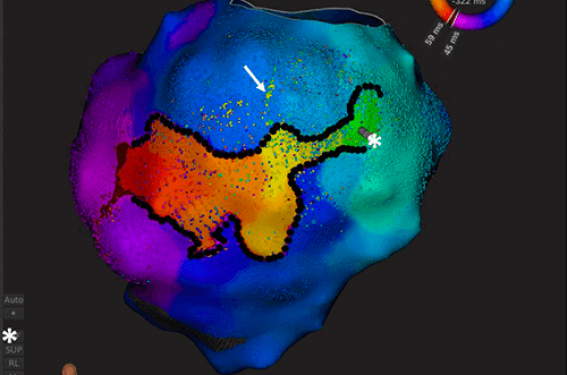
Figure 1. Activation d’une tachycardie ventriculaire sur séquelle d’infarctus inférieur cartographiée avec le système Rhythmia®. Les signaux enregistrés dans l’isthme critique
(astérisque) ont une amplitude de 0,06 mV. Parfois, dans les tachycardies atriales sur oreillettes remaniées, ces signaux critiques peuvent être inférieurs à 0,05 mV, d’où l’importance d’un excellent rapport signal/bruit. La flèche identifie des points dont la couleur (jaune) est différente de la couleur environnante (bleue). Cela signifie que le temps d’activation de ces points n’est pas le même que celui de la zone dans laquelle ils se trouvent. Il faut donc aller vérifier l’annotation de ces points pour voir s’il y a une erreur ou s’il s’agit de points particuliers (fragmentation). Cette représentation permet de s’en apercevoir au premier coup d’oeil malgré plus de 12 000 EGM acquis.
Réglages (gains, filtres)
En ce qui concerne le gain, le but est d’avoir le gain maximal pour identifier les EGM bas voltés. Cela n’influe pas directement sur la réalisation de la carte, car le système ne prend pas cela en compte, mais cela permet de confirmer que le système identifie la même chose que l’opérateur et d’avoir une idée du ratio signal/bruit. En effet, si les gains sont trop faibles, l’opérateur ne pourra pas savoir quelle partie du signal a été annotée par le système et s’il en existe des plus petits non annotés. On utilise des gains permettant de visualiser des EGM avec une amplification de 1 cm pour 0,1 mV.
En ce qui concerne les filtres, certains sont intrinsèques au système de cartographie et donc non modifiables. Par contre, il existe des filtres réglables. Le but est de filtrer le signal le moins possible, car si les filtres font disparaître une partie du bruit, ils risquent d’éliminer également du signal. À titre d’exemple, nos filtres passe-haut sont réglés entre 16/30 Hz et les passe-bas entre 250/500 Hz pour les dérivations bipolaires et entre 0,5/2 et 250 Hz pour les unipolaires.
Type de cathéter et taille des électrodes
La taille des électrodes impacte directement l’EGM enregistré, mais également le rapport signal/bruit. Le rapport entre l’amplitude du signal local (near-field) et lointain (far-field) est différent en fonction du type de cathéter utilisé, particulièrement dans les zones bordantes. Le cathéter d’ablation avec des électrodes et un espace interélectrodes plus larges verra plus le far-field, alors qu’un cathéter avec petites électrodes et espace interélectrodes court verra mieux les potentiels locaux (figure 2) (Berte et al. J Cardiovasc Electrophyl 2015). Autant pour reconstituer une macro réentrée sur myocarde sain, cela ne fera pas trop de différence, autant pour une tachycardie dont l’isthme est constitué d’EGM altérés, cela pourra faire toute la différence pour comprendre ou non le circuit.
Figure 2. Les 2 panels montrent des points pris exactement au même endroit. Sur le panel de gauche (Thermocool®) le signal (MAP 1-2) est enregistré avec un cathéter d’ablation Thermocool® (Biosense Webster) et donc une électrode large. Le signal du panel de droite est enregistré par un cathéter multipolaire avec petites électrodes et un espace inter-électrodes court (Pentaray®, Biosense Webster). Dans les zones cicatricielles, les cathéters d’ablation (électrodes larges) identifient mieux le far-field que le near-field, alors que c’est l’inverse lorsque le signal est enregistré avec des cathéters avec petites électrodes et espace interélectrodes limité. On a donc une meilleure idée de ce qu’il se passe localement avec ces derniers lorsqu’on cartographie des zones cicatricielles.
Reconstruction de l’activité à partir des électrogrammes
Annotation automatique des signaux
En annotant le signal, on opère en fait une réduction dimensionnelle : chaque signal enregistré qui correspond à un voltage qui varie sur plusieurs secondes se retrouve « résumé » à une seule valeur : le temps d’activation local. Ce choix est donc obligatoirement réducteur et est effectué selon des règles automatiques imparfaites.
D’un point de vue théorique, le passage d’un front d’activation devant une électrode (temps d’activation locale LAT) de recueil unipolaire correspond à l’instant de pente négative maximale (-dV/dT max). Une configuration bipolaire revient à mesurer un gradient spatial de potentiel, et dans ce cas le LAT correspond à l’instant d’amplitude maximale (en valeur absolue) du signal.
Ces principes théoriques sont valables pour un front d’activation homogène se déplaçant dans un tissu sain. Dans ce cas, le signal enregistré est non-ambigu, et il n’y a généralement pas de problème d’annotation, attention tout de même à avoir une référence stable (figure 3). L’annotation des signaux complexes (fragmentés, doubles…) est sujette à erreurs, notamment parce que dans ce cas, la composante du signal provenant du tissu le plus proche (near-field) peut être faible par rapport aux contributions plus distantes (far-field), si bien que l’instant de -dV/dT max unipolaire ou de maximum d’amplitude bipolaire ne correspondent plus au LAT.
Figure 3. Carte d’activation d’une tachycardie atriale para-sinusale utilisant l’algorithme « HD coloring » du système CARTO®. Il aide à identifier les zones de bloc de conduction ou de conduction lente. Les panels A et B montrent l’activation de 2 points contigus. Le problème est que la référence est tantôt calée sur l’oreillette (panel A) tantôt sur le signal ventriculaire (panel B) du sinus coronaire. Dès lors les temps d’activation (pour le système) entre ces 2 points proches vont être extrêmement longs et se traduire sur la carte par ces zones blanches dites de « bloc » qui ne sont dues qu’au problème de référence variable. L’autre limite pour identifier ces zones de bloc avec cet algorithme qui se base sur le temps entre 2 points contigus est d’avoir une densité de points suffisante afin que 2 points ne soient pas trop éloignés, car l’algorithme se base sur le délai d’activation entre 2 points mais ne prend pas en compte la distance. Lorsqu’on utilise cet algorithme, il faut donc régler le « filter and color threshold » à 5. Une fois les points aberrants (avec problème d’annotation de référence) enlevés, la carte d’activation (panel C) brute puis traitée avec l’algorithme « COHERENT » (panel D) devient cohérente et montre l’origine de la tachycardie.
Lorsque le nombre de points est limité, une ré-annotation manuelle du temps d’activation est habituellement possible, l’objectif étant de créer une séquence d’activation spatialement cohérente et pouvant expliquer l’arythmie. On cherche habituellement à couvrir l’ensemble du cycle de la tachycardie.
Les systèmes de cartographie actuels enregistrent jusqu’à une dizaine de milliers de signaux afin de construire une carte spatialement dense. Dans ce contexte, il est évidemment impossible de vérifier et de corriger l’annotation de chaque signal. Pour cette raison, les différents constructeurs ont proposé des solutions techniques permettant d’améliorer automatiquement la carte finale. Le système Precision® (Abbott) a été ainsi le premier à proposer différentes alternatives d’annotation. Une possibilité intéressante avec ce système est celle d’annoter automatiquement les potentiels les plus tardifs.
Le système CARTO® (Biosense Webster) propose l’utilisation d’une annotation combinant la dV/dT de la dérivation bipolaire à la plus classique dV/dT unipolaire. Pour chaque point, le signal bipolaire est utilisé pour borner une fenêtre d’intérêt au sein de laquelle se situe le LAT, et l’unipolaire (-dV/dT max) est ensuite utilisé pour choisir le LAT parmi les candidats dans cette fenêtre. L’apport principal de cette technique est l’annotation précise de tissu sain. Par contre, il n’y a pas d’amélioration attendue sur les signaux injustement annotés sur la composante far-field, problème principal de la cartographie de tachycardies en tissu pathologique. Lorsque l’annotation automatique se fait sur ces composantes far-field, il peut être utile de réannoter semi-automatiquement l’ensemble de la carte en resserrant la fenêtre d’intérêt sur la partie mid-diastolique du circuit (figure 4).
Figure 4. Exemple d’une carte d’activation de tachycardie ventriculaire avec le système CARTO. Le panel A montre l’activation automatique des signaux en TV basée sur le Wave Front Annotation. Les tracés roses sont les 2 unipolaires qui sont présentes en même temps que le QRS, car il s’agit de la masse myocardique la plus importante en termes de dépolarisation. Il annote donc le signal bipolaire présent dans le QRS (flèche) et non celui en début de diastole (astérisque). Il est impossible sur la carte qui en résulte de comprendre le circuit de la tachycardie. Si on modifie la fenêtre d’intérêt (panel B) pour ne garder que la zones entre 2 QRS, on va perdre les données de ce qu’il se passe dans le QRS mais se focaliser sur l’activation diastolique qui sera automatiquement annotée et qui inclut généralement l’isthme critique dans les réentrées sur cicatrice. Avec les mêmes informations mais en changeant la fenêtre d’intérêt qui entraîne une réannotation automatique des signaux diastoliques, la carte devient cohérente.
Une autre alternative est le ripple-mapping, qui tranche avec le concept de LAT en permettant de visualiser l’ensemble du signal à l’aide de petites barres dont la longueur varie avec l’amplitude du signal bipolaire à chaque instant. Si un signal a deux composantes distinctes, il clignotera au passage des deux fronts d’activation.
Le système LUMIPOINT du Rhythmia® permet d’identifier les zones en cours d’activation sur un intervalle de temps donné (la fenêtre d’intérêt est généralement la mid-diastole). L’algorithme permet ensuite de forcer la réannotation des points qui s’activent pendant l’intervalle défini manuellement, permettant donc une réannotation semi-automatique de la carte d’activation restreinte à la zone d’intérêt (figure 5).
Figure 5. Trois cartes d’activation de tachycardie ventriculaire obtenues durant la même acquisition en 35 secondes avec un cathéter Orion® et le système Rhythmia®.
Le panel A montre l’activation basée sur l’annotation automatique en direct, on ne comprend pas le circuit et il est impossible de collecter plus de points car la TV a dû être arrêtée car mal tolérée. Lorsqu’on regarde les signaux, on se rend compte que ce sont les signaux far-field du QRS qui sont annotés (flèche) et non les signaux mid-diastoliques correspondant à la zone de conduction lente. Sur le panel B, on utilise l’algorithme LUMIPOINT. On règle la fenêtre d’intérêt (fenêtre verte transparente) sur la zone mid-diastolique, on voit donc apparaître sur la carte les zones avec des potentiels présents durant cette fenêtre puis on demande au système d’annoter ces signaux (flèche panel C) pour obtenir la carte du panel C qui montre cette fois-ci clairement l’activation dans l’isthme. Ainsi en 3 clics, on est passé d’une carte incohérente à une carte cohérente.
Problème de l’interpolation
Une fois qu’on est sûr que les points sont bien annotés, il faut avoir une bonne densité de points dans les zones clés, en particulier dans les zones bas-voltées ou de conduction lente. Par contre on peut n’avoir que peu de points dans les zones saines. Lorsque l’on ne comprend pas bien ce qu’il se passe dans certaines zones, il faut prendre plus de points et aller revérifier l’annotation dans cette zone. Des algorithmes ont été ajoutés pour essayer d’améliorer l’identification/visualisation des mécanismes des arythmies. Il faut faire très attention à leur mode de fonctionnement et leurs limites, car ils peuvent induire en erreur s’ils sont mal utilisés (figure 3).
Confirmation du mécanisme de la tachycardie
Une fois la carte produite, il est indispensable de regarder les signaux dans la zone semblant être critique (origine de l’activation si mécanisme d’allure focal ou isthme/zone de conduction lente si réentrée). Une fois la carte vérifiée, il faut si possible confirmer le circuit avec des manoeuvres d’entrainement, et ce quel que soit le pattern d’activation. En effet, une carte d’activation d’allure focale peut correspondre à une tachycardie macroréentrante avec une partie du circuit nonaccessible depuis la cavité cartographiée (exemple : passage épicardique).
Conclusion
Nous n’avons pas la place dans cet article de détailler les avantages et surtout les limites des différents algorithmes qui servent à faire ces cartes, mais il est indispensable de bien connaître ceux que vous utilisez pour éviter de se faire piéger.
Ainsi pour obtenir une carte cohérente, il est indispensable : 1. d’avoir un excellent ratio signal/bruit ; 2. de contrôler l’annotation des points en cas d’incohérence (surtout dans les zones cicatricielles) ; 3. d’avoir une bonne densité de points dans les zones complexes (bas voltées, fragmentées…) ; 4. de confirmer la carte par des manoeuvres d’entrainement.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


