Complication
Publié le 10 juin 2018Lecture 8 min
Prise en charge d’une sténose des veines pulmonaires postablation
Séverine PHILIBERT, Gabriel LAURENT, Groupe Hospitalier Saint-Joseph, Paris ; CHU de Dijon
La prévalence de la fibrillation atriale (FA) est croissante avec le vieillissement de la population, elle devrait affecter 14 à 17 millions d’européens en 2030. Actuellement, en France, 500 000 à 1 million de personnes sont concernées (soit 1 % de la population générale)(1-4). L’ablation de la FA (paroxystique ou persistante) est un traitement de choix pour les patients symptomatiques. Les toutes dernières études publiées vont d’ailleurs certainement conduire à un élargissement du champ des indications(5).
Selon les recommandations actuelles, les techniques ablatives doivent se concentrer principalement autour des veines pulmonaires (VP) afin de les déconnecter électriquement du reste de l’oreillette gauche. Même si cette technique est aujourd’hui assez bien codifiée et réalisée dans des centres compétents, elle reste associée à un taux non négligeable de complications au rang desquelles il y a la sténose de veines pulmonaires.
La sténose des veines pulmonaires est une complication rare et classiquement associée aux dommages thermiques causés par les brûlures autour des ostia des veines. La physiopathologie est mal connue, cependant les risques sont accrus si les brûlures réalisées sont trop ostiales, circonférentielles et a fortiori à l’intérieur même des veines pulmonaires. C’est ce que les premiers opérateurs ont rapidement observés à la fin des années 1990.
L’incidence des sténoses des VP évolue selon les techniques et l’expérience des praticiens
L’incidence publiée de la sténose des VP post-ablation de FA varie considérablement selon les définitions, les techniques d’ablation, les méthodes et protocoles de dépistage (aigu/chronique), et l’ancienneté des séries rapportées (de 0 à 38 %). Une revue systématique récente suggère qu’elle se situe autour de 2 %(6). Les sténoses symptomatiques nécessitant un traitement invasif semblent en régression (0,6 % dans la première série mondiale, vs 0,29 % dans la seconde réalisée de 2003 à 2006)(7). Mais il faut garder à l’esprit que la véritable incidence est certainement sous-estimée car cette complication n’est pas recherchée de manière systématique et même parfois sous-diagnostiquée chez des patients pourtant symptomatiques.
Taux de sténose de VP selon le type d’ablation
C’est davantage la localisation ostiale des brûlures que le type d’énergie délivré (radiofréquence ou cryothérapie) qui est en cause dans la sténose de VP. En cryo-ablation, c’est pour cette raison que la plupart des opérateurs utilisent préférentiellement le ballon de plus grande taille et de deuxième génération (28 mm vs 23 mm). La plus grande surface de distribution du liquide de refroidissement améliore la qualité des brûlures qui en raison du plus grand diamètre du ballon se projettent au niveau de l’antrum des veines.
L’étude STAR-AF publiée en 2013 a comparé la cryoablation au traitement médicamenteux dans la FA paroxystique, avec un taux de sténose de 2,1 % (4/186) après une seule procédure et de 6,5 % (2/31) après une seconde procédure(8). L’étude FIRE and ICE publiée en 2016, a inclus 769 patients sans aucune sténose rapportée lors du suivi à 12 mois(9). Dans SMART-AF publiée en 2014, l’utilisation du cathéter de contact ThermoCool® SmartTouch™ (Biosense Webster) n’a été responsable d’aucune sténose de VP à 1 an(10).
Même si ces études très récentes peuvent nous suggérer que cette complication peut être prévenue, il faut rester vigilant et attentif car le risque persiste.
Quels sont les symptômes qui doivent alerter ?
Les symptômes varient selon le nombre de VP sténosées, leur degré de sténose et le niveau d’activité physique du patient. Lorsqu’un dépistage systématique est organisé, on peut identifier jusqu’à 8 % de sténoses asymptomatiques(11, 12). Des limitations physiques discrètes peuvent commencer dans les jours suivant l’ablation, mais dans la majorité des cas les symptômes apparaissent entre le 1er et le 12e mois suivant la procédure. Les plaintes les plus courantes sont non spécifiques et comprennent une dyspnée d’effort, des douleurs thoraciques, parfois d’allure pleurale, une fatigue, une toux persistante, des symptômes pseudo-grippaux. Si l’hémoptysie est la manifestation la plus spécifique, elle ne survient que chez une minorité de patients. Il est important d’informer les patients et les médecins correspondants de cette complication rare, mais toujours possible.
Quels sont les examens à réaliser ?
Une fois le diagnostic évoqué sur la clinique, il convient de réaliser une imagerie par scanner (figure 1) ou IRM ainsi que des examens fonctionnels pour apprécier le retentissement de la sténose : scintigraphie de ventilation/perfusion (figure 2), spirométrie et gaz du sang.
Les critères radiographiques comprennent une réduction du diamètre veineux pulmonaire de plus de 50 % par rapport à un examen de référence réalisé en préablation ou une réduction de la section transversale de la VP > 75 %. Une sténose est estimée comme légère (< 50 %), modérée (50 à 70 %) ou sévère (> 70 %)(13-14).
Figure 1. Étude scannographique avant et après l’implantation d’un stent dans la veine pulmonaire inférieure gauche. A : La veine pulmonaire inférieure gauche n’est pas visualisée en raison d’une sténose ostiale très serrée. B : Visualisation du stent avec réouverture du vaisseau.
Figure 2. Étude scintigraphique pulmonaire chez un patient présentant une occlusion de la VPSG et une sténose serrée de la VPIG (ventilation et perfusion). Avant implantation du stent la ventilation est réduite et la perfusion est inexistante à gauche coïncidant avec le tableau clinique. Un mois après la mise en place d’un stent dans la veine pulmonaire inférieure gauche, on identifie un certain degré de perfusion chez ce patient qui présente une amélioration clinique nette.
Quelle est la prise en charge des sténoses de VP ?
Les patients qui présentent une sténose voire même une occlusion unique de VP sont souvent asymptomatiques et doivent être surveillés par imagerie et test fonctionnels réguliers. Ceux présentant une sténose concomitante et significative d’une autre VP, et a fortiori s’il s’agit d’une veine ipsilatérale à la VP occluse, nécessitent des interventions précoces, voire répétées, pour restaurer le flux d’au moins une veine.
Les retards diagnostiques liés à l’absence de dépistage systématique et à une méconnaissance de cette pathologie peuvent être préjudiciables. En effet, l’évolution vers une occlusion définitive (non reperméabilisable) peut se produire lorsque s’installe une fibrose dense qui conduit alors à une atteinte pulmonaire parenchymateuse.
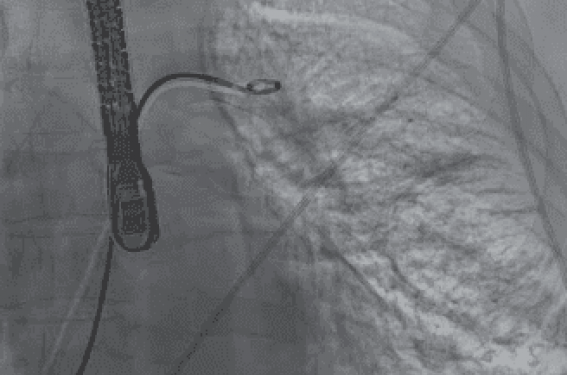
On ignore aujourd’hui si un diagnostic et un traitement précoces d’une sténose de VP asymptomatique fourni à long terme est un avantage pour le patient. On doit proposer aux patients présentant une ou plusieurs sténoses significatives, une prise en charge invasive après les avoir informés des risques inhérents à une procédure d’angioplastie de VP. Si l’angiographie (figure 3) confirme qu’il s’agit d’une sténose sévère, une angioplastie peut être réalisée pour empêcher la progression vers l’occlusion définitive (figure 4). L’angioplastie par ballonnet est rarement suffisante et doit être complétée par la mise en place d’un stent de grand diamètre (généralement 10 mm), afin de prévenir la resténose fréquente(15-16).
Figure 3. Angiographie pulmonaire numérisée droite (A) et gauche (B), temps artériel pulmonaire (image de gauche) et temps veineux pulmonaire (image de droite). B : L’arbre artériel pulmonaire gauche est très réduit et le temps veineux est inexistant en raison d’une double sténose serrée des veines pulmonaires gauches postablation de FA (2 procédures dont la dernière 1 an auparavant). Noter la présence d’un épanchement pleural gauche chronique. C : Après mise en place du stent, l’arbre artériel pulmonaire gauche est inchangé. En revanche, il existe un certain degré de retour veineux par la VPIG dans l’oreillette gauche.
Figure 4. Procédure d’angioplastie. A : mise en place du guide. B : angiographie distale de la VPIG. C : angioplastie au ballon. D : angiographie post angioplastie immédiate : ouverture de la veine. E : positionnement du stent. F : mise en place du stent et angiographie de contrôle.
Les données publiées sur les résultats des interventions de dilatation percutanées sont limitées à de petites séries de cas avec des résultats mitigés (tableau). Le taux de resténose par veine après dilatation avec succès varie de 30 à 73 %, et de 0 à 57 % après mise en place d’un stent.
La plus large série de cas a inclus 34 patients avec 55 veines sténosées traitées avec succès. Le taux de resténose à 2 ans dans cette équipe entraînée était de 72 % après angioplastie et 33 % après mise en place d’un stent (HR : 2,6 ; p = 0,003)(17). Dans certains cas (comme les bifurcations), des stents à élution médicamenteuse peuvent être utilisés mais les données de suivi restent anecdotiques(18, 19).
Dans tous les cas, une surveillance rapprochée est cruciale car la resténose peut progresser rapidement. Tous les patients doivent être avisés de consulter immédiatement s’ils éprouvent des symptômes récurrents.
Il n’y a pas de données contrôlées sur les thérapies adjuvantes optimales. L’utilisation d’une thérapie antithrombotique est fortement conseillée avec une prémédication à base de clopidogrel (300-600 mg) et la poursuite à une posologie de 75 mg par jour indéfiniment en association à une anticoagulation curative.
En cas de resténose intrastent, il peut être envisagé de mettre un nouveau stent si le patient est très symptomatique. Le rôle de la chirurgie n’est pas défini mais peut être considéré au cas par cas après échec d’une procédure d’angioplastie avec stent.
Conclusion
En dépit des progrès techniques, la sténose des veines pulmonaires reste une complication parfois sévère de l’ablation de la FA. Souvent asymptomatique lorsqu’une seule veine est touchée, l’atteinte de deux veines ipsilatérales peut générer un handicap fonctionnel important. L’absence de dépistage systématique et une méconnaissance de cette pathologie (dont la symptomatologie pulmonaire peut tromper les cliniciens), peuvent être responsables d’un diagnostic tardif préjudiciable.
En effet, une occlusion complète avec fibrose est parfois impossible à reperméabiliser et le risque de resténose après angioplastie avec stent est élevé.
Il serait souhaitable de proposer à tous les patients atteints de sténoses significatives et symptomatiques de VP de bénéficier d’une procédure invasive la plus précoce possible.
Un diagnostic différentiel auquel il faudra également penser devant la présence d’une dyspnée en post-ablation est la paralysie diaphragmatique, simple à éliminer avec une radio pulmonaire.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


