Training
Publié le 29 fév 2016Lecture 7 min
La valvuloplastie aortique à l'ère du TAVI : qu’en est-il en 2016 ?
A. TIROUVANZIAM, NCN le Confluent, Institut Jacques Cartier, Massy
La valvuloplastie aortique (VAB) au ballon a été développée en 1985 par Alain Cribier comme une alternative au remplacement valvulaire aortique (RVAo), chez les patients âgés à haut risque chirurgical présentant une sténose aortique dégénérative(1).
La VAB a pour objectif de fracturer des nodules calcaires, d'élargir l'anneau aortique et de scinder les commissures fusionnées.Le succès de la procédure est défini par l’obtention d’une surface valvulaire supérieure à 1 cm2 et/ou une diminution de plus de 50 % du gradient moyen transvalvulaire.
Après un engouement initial légitime, la VAB a démontré depuis lors, un taux élevé de resténose (de 40 à 80 % à 9 mois selon les séries), de complications (notamment vasculaires) et l'absence d'amélioration de la survie à long terme(2).
Son usage a été ainsi limité aux patients à très haut risque, en insuffisance cardiaque et/ou en état de choc cardiogénique, dans la perspective éventuelle d'un RVAo.
Les recommandations de 2014 consièrent la VAB comme étant en classe II B avec un niveau de preuves C(3), chez les patients symptomatiques présentant une sténose aortique serrée en attente (stand by) de RVAo ou de TAVI (transaortic valve implantation).
La VAB connaît désormais une résurgence liée essentiellement au développement du TAVI, mais aussi au raffinement de la procédure – diminution de la taille des introducteurs, abord et fermeture percutanés transfémoraux sous anesthésie locale, stimulation ventriculaire droite rapide pour la stabilisation du ballonnet dans l'orifice, réduction de l'anticoagulation perprocédure –, élargissant ainsi ses indications initiales.
La VAB est désormais utilisée dans trois grands types de situations cliniques : en attente (stand by) d'un traitement curatif, en périprocédural du TAVI et, enfin, en palliatif.
VAB en attente d'un traitement curatif
Elle s'adresse aux patients qui ne sont pas éligibles directement pour ce traitement : dysfonction ventriculaire gauche sévère, insuffisance mitrale supérieure à 3, insuffisance rénale, dysfonction organique potentiellement réversible après valvuloplastie, symptômes intriqués avec pneumopathie associée, chirurgie extracardiaque urgente, fragilité et/ou état préopératoire altéré, enfin, nécessité d'une revascularisation coronaire préalable(4), cette dernière pouvant être réalisée dans le même temps opératoire que la VAB.
Enfin, chez les patients hémodynamiquement instables avec une fraction d’éjection ventriculaire gauche < 30 %, la VAB a un double rôle thérapeutique et pronostique, permettant en cas de réversibilité de la dysfonction, de réorienter le patient, soit vers le traitement curatif, soit dans le cas contraire, vers un traitement médicamenteux optimisé.
Les facteurs associés à une amélioration significative de la fraction d'éjection dans en cas de dysfonction initiale sont : l'absence de coronaropathie préalable, une augmentation de la surface aortique supérieure à 0,2 cm2 et une fraction d'éjection préopératoire plus élevée.
Un suivi entre 15 jours et 1 mois (afin d’éviter la période de resténose) est préconisé pour ces patients et comprend une réévaluation de la classe NYHA, de la FEVG en échocardiographie, l’évolution du taux de NTproBNP et permet de statuer sur la conduite à tenir ultérieure.
VAB et procédure de TAVI
VAB préimplantation
La réalisation de la VAB juste avant l’implantation finale de la prothèse dans l'orifice présente plusieurs intérêts pour de nombreuses équipes :
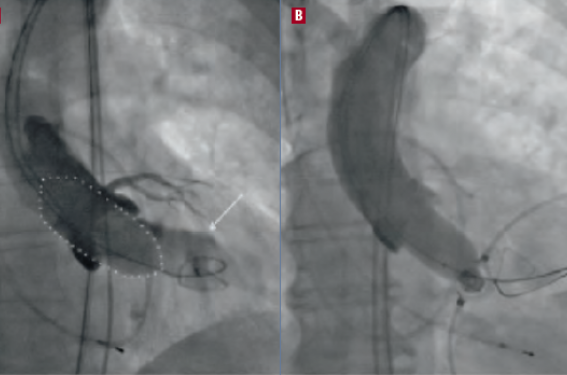
Mesure définitive de l'anneau par angiographie supra-aortique simultanée (figure 1), en cas de doute persistant sur le choix de la prothèse, après échographie et angioscanner traditionnels.
Vérification de l'absence d'obstruction du tronc commun coronaire gauche en cas de calcification volumineuse siégeant sur la sigmoïde antérogauche et de naissance basse entre 8 et 10 mm du réseau gauche.
Facilitation du franchissement de la prothèse. À cet effet, la règle est désormais l'utilisation d'un ballon de taille sous-dimensionnée (inférieure à celle de l'anneau) pour limiter les risques de rupture avec tamponnade et/ou d'insuffisance aortique sévère, et éviter ainsi une procédure de TAVI réalisée dans des conditions d'urgence extrême et hémodynamiquement précaire. La tendance compte tenu du profil réduit des dispositifs de dernière génération* va même à l'implantation directe sans valvuloplastie préalable, une transposition du stenting direct coronaire.
Cette technique de pause simplifiée réalisable dans plus de 95 % des cas offre de nombreux avantages : réduction de la durée de la procédure, moindre irradiation, limitation des séquences de stimulation ventriculaire rapide, meilleure tolérance hémodynamique en cas de dysfonction VG et potentielle réduction des emboles cérébraux liés au passages itératifs de la crosse aortique.
L'absence de valvuloplastie est préconisée par de nombreuses équipes lors du déploiement de la valve, notamment autoexpansible. Elle est également désormais la règle lors des procédures dites de « Valve in valve » dans le traitement des dégénérescences de bioprothèses aortiques.
Figure 1. Mesure définitive de l'anneau par angiographie supra-aortique simultanée.
L’implantation directe de la prothèse expose néanmoins à un risque faible d’échec de franchissement, en cas de présence de sténose aortique critique, avec des sigmoïdes massivement calcifiées, de coudure septo-aortique et de VG de petite taille, rendant le support et la trackabilité de la prothèse complexes.
De plus, la VAB n'a pas fait la preuve définitive de son avantage dans les études par rapport à la technique conventionnelle, et elle n'est pas recommandée en phase d'apprentissage.
*Valves SAPIEN 3 en 14 F 23 et 26 mm et Valve SAPIEN 3 en 16 F 29 mm d’Edwards Lifesciences ; CoreValve Evolut™ R de Medtronic.
VAB postdilatation
L'évolution technologique a permis une réduction significative du taux de fuite paravalvulaire sévère résiduelle post-TAVI. Elle reste le facteur limitant à une extension des indications à une population de patients plus jeunes et/ou à faible risque opératoire. Sa sévérité entraîne une surmortalité et un pronostic défavorable à long terme.
La fuite paravalvulaire supérieure à un grade 2 est évaluée à 30 jours à près de 2,5 % avec la SAPIEN 3 et 3,4 % avec la Core-Valve Evolut™ R, selon les études les plus récentes relatives aux deux dispositifs.
La postdilatation doit être la règle en cas de fuite paravalvulaire hémodynamiquement mal tolérée (chute de la pression diastolique, absence ou disparition de l'onde dicrote, index de régurgitation ([PAD-LVEDP]/PAS x 100 inférieur à 25)(5) et nécessite l'usage d'un ballon dont le diamètre ne doit pas excéder celui du diamètre moyen de l'anneau. Elle est le plus souvent prévenue par un positionnement, une expansion ainsi qu'un choix corrects de la prothèse.
VAB isolée sans stand by
L'obtention d'une surface postopératoire de 1 cm2 améliore la qualité de vie et la classe fonctionnelle NYHA des patients à court terme (3 mois en moyenne), sans modifier la courbe de survie à long terme (figure 2).
La mortalité à 12 mois dans cette population est proportionnelle aux comorbidités et au score STS (30 % si STS < 10 ; 50 % si STS entre 10 et 15 ; 70 % si STS > 15)(6).
Figure 2. Courbe de survie après VAB.
Le recours à la valvuloplastie itérative doit rester exceptionnel et discuté au cas par cas en raison de la diminution progressive de son efficacité dans le temps et du risque accru de complications liées à la fragilisation de l'anneau.
VAB et complications
L'amélioration constante de la technique depuis sa naissance a contribué à une réduction significative des complications hospitalières (tableau 1). On note selon les séries, 2,5 à 6 % de complications vasculaires, 1,1 à 2,6 % d'insuffisances aortiques sévères, 0,5 à 2,5 % d'AVC, 0,6 à 1,3 % de pacemakers et une quasi-disparition de l'infarctus du myocarde.
Les décès (2,5 à 5 %) sont liés à la persistance d'un collapsus après inflation du ballon, à la rupture de l'anneau ou à la tamponnade par perforation des cavités ventriculaires(7).
La majorité de ces complications fatales est évitable par la réalisation d'inflations courtes, chez un patient hémodynamiquement stable et par la manipulation prudente des sondes et des guides stiff dans les cavités.
Une attention particulière doit être portée à la préformation du guide et à son positionnement stable dans le VG.
VAB : la technique
La VAB est réalisée sous anesthésie locale par voie transfémorale, après vérification de la perméabilité des axes vasculaires et l'absence d'artériopathie oblitérante proximale.
L'héparine non fractionnée à la dose de 0,5 à 0,75 mg/kg en bolus IV est administrée après insertion d'un désilet compatible avec le(s) ballon(s) utilisé(s) pour la procédure (tableau 2).
La sélection du ballon est basée sur les mesures préalables de l'anneau en échocardiographie transthoracique, de l’IMC (indice de masse cor-porelle) et/ou de l'angiographie sus-sigmoïdienne.
Une stimulation ventriculaire droite rapide est réalisée durant l'inflation à 180-200 atm par minute. Celle-ci est désormais remplacée par une stimulation ventriculaire gauche directe à partir du guide extrastiff (figure 3). Cette technique a l'avantage de simplifier, de raccourcir la procédure et de limiter les risques de complications liées à la sonde ventriculaire droite. L'hémostase de la voie d'abord est obtenue par la réalisation d'une préfermeture avec suture 6 F au Perclose ProGlide (Abbott Vascular) ou par fermeture au collagène 8 F Angio-Seal® (St. Jude Medical) et antagonisation finale de l'héparine.
Figure 3. Matériel de stimulation ventriculaire.
VAB : Perspectives d’innovations
Sans espérer atteindre l'efficacité du TAVI, la VAB fait l'objet d'une recherche technologique active afin d'en améliorer l’efficacité.
Ballon en sablier (stabilisation annulaire), en Kevlar® (résistance à la rupture), à perfusion centrale (pour une meilleure tolérance aux inflations prolongées), scoring balloon en nitinol, voire ballon couplé à ondes de choc lithotripsiques pour décalcification valvulaire.
La place des nouveaux anticoagulants par rapport à l'héparine non fractionnée (HNF) reste également à définir. A. Kini et al.(8) ont démontré en comparaison de l'HNF une réduction des saignements majeurs sous bivalirudine (Angiomax®, the Medecines Company) sans différence significative quant à la mortalité, les infarctus, les AVC ou les complications vasculaires. Ces résultats doivent être confirmés par des études randomisées pour être généralisés et éventuellement transposables au TAVI.
Conclusion
La valvuloplastie aortique percutanée connaît en 2016 un regain d'intérêt et une extension de ses indications initiales, liés au développement du TAVI.
Ses applications cliniques incluent désormais le stand by en vue d'un traitement curatif chirurgical ou percutané, le périprocédural du TAVI et le traitement palliatif chez des patients sélectionnés inéligibles à un traitement curatif.
Sa sécurité et son efficacité devraient être renforcées par les évolutions technologiques et pharmacologiques futures.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


