Thérapeutique
Publié le 07 oct 2013Lecture 12 min
Thérapie cellulaire : bilan d’une décennie
P. MENASCHÉ, Département de chirurgie cardiaque, HEGP, université Paris-Descartes, Paris
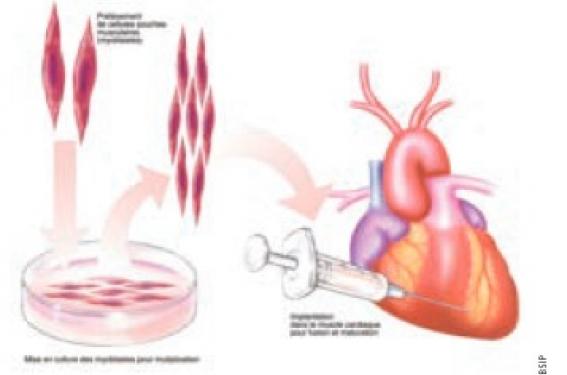
Depuis un peu plus d’une dizaine d’années (la première implantation intramyocardique humaine de cellules musculaires remonte à 2000), la thérapie cellulaire s’est imposée comme l’une des nouvelles options possibles pour améliorer le traitement de l’infarctus du myocarde et de l’insuffisance cardiaque chronique.
Aux multiples travaux expérimentaux ont succédé (lorsqu’elles ne les ont pas précédés...) d’aussi nombreuses études cliniques dont les résultats contrastés ont fait naître un sentiment de scepticisme à hauteur des espoirs excessifs que ce nouveau concept avait suscités.
Le moment semble donc venu de tirer un bilan global de cette première décennie, et surtout de réfléchir à la manière dont tous ces résultats peuvent être utilisés pour bâtir, de façon plus efficace, la seconde génération d’essais cliniques.
Résultats dans l’infarctus du myocarde
Dans le cadre de l’infarctus du myocarde vu au stade aigu, rappelons que la procédure la plus couramment utilisée a été l’infusion de cellules mononucléées autologues de la moelle sanguine dans l’artère coronaire responsable de l’infarctus, préalablement rouverte. L’administration d’une fraction purifiée de ces cellules (progéniteurs CD34 +) a été plus rare tout comme l’injection intraveineuse de cellules souches mésenchymateuses allogéniques, créditées d’un privilège immunologique autorisant une telle origine, sans traitement immunosuppresseur associé. Sans doute le résultat qui résume le mieux ces essais est-il celui, récemment publié, d’une métaanalyse entreprise par le centre Cochrane(1).
L’analyse de 1 765 patients inclus dans 33 essais contrôlés randomisés fait ainsi apparaître, en dépit d’une très forte hétérogénéité entre les séries, un modeste bénéfice de la thérapie cellulaire sur la fonction ventriculaire gauche : le gain en termes de fraction d’éjection ventriculaire gauche, par comparaison aux patients des groupes contrôles, est de 2,87% et se maintient à long terme (3,75% avec un suivi de 12 à 61 mois) sans conséquence (comme cela était prévisible) sur la morbi-mortalité.
Fait notable, les différences ne sont statistiquement signifi- catives entre les groupes contrôles et traités que lorsque l’évaluation fonctionnelle est fondée sur l’échographie ; elles ne le sont pas dans les séries utilisant l’imagerie par réso- nance magnétique (IRM).
Indépendamment de la technique d’évaluation, plusieurs paramètres influençant les résultats ont pu être identifiés, notamment le degré d’altération initiale de la fonction ventriculaire gauche (les patients chez lesquels elle est le plus altérée étant ceux qui semblent bénéficier le plus de la thérapie cellulaire), la dose de cellules injectées, la technique de leur préparation (avec un effet inhibiteur de l’héparine) et le moment précis de l’injection (une thérapie différée au-delà d’environ une semaine semblant perdre toute efficacité).
Au-delà de ces enseignements naturellement précieux pour mettre en place des essais dont l’optimisation passe par leur prise en compte, une observation essentielle est le caractère souvent défectueux de la fonction même des cellules médullaires chez les patients présentant les facteurs de risque de maladie athéromateuse. Le paradoxe est donc d’utiliser un traitement chez des sujets dont la maladie sous-jacente fait qu’il risque d’être peu efficace. Pour remédier à ce problème, une solution est d’essayer de corriger in vitro les anomalies fonctionnelles des cellules médullaires avant de les injecter. Conceptuellement élégante, techniquement réalisable dans un contexte expérimental, cette approche semble assez peu réaliste en clinique.
L’alternative est d’utiliser des cellules allogéniques provenant de banques dûment qualifiées, notamment sur le plan fonctionnel. Cette approche est celle qui a été utilisée avec des cellules mésenchymateuses ; les résultats en sont jugés excellents par la société promotrice de l’essai (Osiris) sans qu’il soit facile de faire la part entre les gages à donner à des investisseurs inquiets et la réalité médicale. Il n’en reste pas moins que cette thérapie allogénique présente d’indiscutables avantages : validation fonctionnelle et reproductibilité des lots de cellules, simplification logistique, disponibilité immédiate ; elle peut par ailleurs se justifier par l’observation, également bien établie, que les cellules injectées ne vont pas « devenir » des cellules cardiaques ou vasculaires et que leur rôle est avant tout de sécréter des facteurs susceptibles d’activer des voies endogènes cytoprotectrices (principalement augmentation de l’angio-genèse, diminution de l’apoptose et de la fibrose) ; dans ces conditions, l’élimination de cellules étrangères par un réponse immune (le privilège immunologique de ces cellules mésenchymateuses est, en effet, très discuté) n’est pas nécessairement un inconvénient dès lors que les cellules ont survécu assez longtemps pour exercer cet effet paracrine, et sur ce plan, les cellules mésenchymateuses (de la moelle sanguine ou du tissu adipeux) sont, en effet, de bons candidats, compte tenu de leur forte activité sécrétoire.
A côté de la fonction des cellules, un autre facteur prédictif du résultat a été identifié : le degré de leur rétention dans le myocarde cible. Malheureusement, les observations concordent pour montrer que cette rétention est très faible. Plusieurs approches sont donc en cours d’évaluation pour tenter d’augmenter le nombre de cellules persistant dans le tissu receveur. Sans doute la plus simple est-elle fondée sur de nouveaux cathéters permettant une extravasation extravasculaire des cellules et diminuant donc d’autant leur fuite vers les poumons ou la rate. Une stratégie plus élaborée, dont les premiers résultats cliniques ont été jugés encourageants, consiste à recourir à des moyens physiques (chocs par ultrasons) pour stimuler la production par le myocarde de facteurs susceptibles d’« attirer » les cellules circulantes et donc de les « figer » dans la zone cible. C’est toutefois une approche classique (injection intracoronaire précoce après l’infarctus de cellules médullaires mononucléées autologues chez des patients dont la fraction d’éjection est ≤ 45%) qui a été retenue pour être évaluée dans un vaste essai européen randomisé dont la taille (3 000 patients) devrait permettre de clarifier la question.
Résultats dans l’insuffisance cardiaque chronique
Dans le cadre de l’insuffisance cardiaque chronique, les résultats publiés à ce jour n’emportent pas davantage la conviction. Qu’il s’agisse de cellules médullaires ou de myoblastes (cellules souches squelettiques), que ces cellules soient injectées par voie épicardique lors de pontages coronaires ou par cathétérisme intracoronaire ou endocardique, aucune amélioration cliniquement pertinente n’a pu être démontrée dans les relativement rares études randomisées, contrôlées et en double insu. Quelques essais ont néanmoins rapporté des résultats encourageants qui concernent habituellement la fonction régionale ou la perfusion et suggèrent qu’un certain effet thérapeutique, même modeste, est néanmoins possible.
Sur la base de données expérimentales concordantes, il est clair cependant que ce bénéfice n’est pas dû, à ce jour, à une véritable régénération du myocarde. En effet, l’espoir d’une plasticité des cellules adultes se transdifférenciant en cardiomyocytes sous l’influence de leur nouvel environnement myocardique semble utopique. Le bénéfice inconstamment observé des injections de cellules musculaires ou médullaires s’explique donc ici encore par l’effet des facteurs sécrétés par les cellules. La vraie question, non tranchée, est de savoir si ces effets paracrines de cellules transplantées dans des cicatrises fibreuses sont suffisamment puissants pour avoir un impact thérapeutique ou s’il ne faut pas plutôt poursuivre l’objectif initial d’un remplacement physique des cellules myocardiques détruites, par la transplantation de cellules intrinsèquement douées d’un véritable potentiel de différenciation cardiomyogénique, susceptibles de s’intégrer sur le plan électromécanique dans le myocarde receveur et pouvant ainsi contribuer à améliorer sa fonction contractile.
SCIPIO et CADUCEUS : deux essais cliniques utilisant des cellules cardiaques
C’est dans ce contexte qu’une forte publicité, liée à l’excellence scientifique du journal qui a publié ces résultats et relayée par les médias, a été donnée à deux essais cliniques qui ont utilisé des cellules cardiaques. Identifiées même comme des cellules souches cardiaques dans le premier (SCIPIO), elles ont été isolées (sur la base d’un marqueur spécifique) et cultivées in vitro à partir d’une biopsie de l’auricule droit réalisée lors d’une intervention de chirurgie cardiaque, avant d’être réinjectées par voie intracoronaire quelques semaines plus tard(2). Les spécialistes s’accordent aujourd’hui à reconnaître que la multitude de failles méthodologiques entachant cet essai ne permet pas de conclure que ces cellules ont réellement exercé un effet « régénérateur » et jette même un doute sur le bénéfice fonctionnel rapporté. Au demeurant, l’existence même de cellules souches cardiaques dans le cœur humain adulte et a fortiori pathologique, qui seraient susceptibles d’être mobilisées et de se substituer aux cardiomyocytes détruits, est fortement discutée.
Plus modeste dans ses ambitions (on y parle de cellules cardiaques sans préjuger de leur caractère de cellules souches), le second essai (CADUCEUS) a consisté à prélever un fragment de muscle ventriculaire droit par biopsie transjugulaire, à en isoler des cellules qui semblent assez hétérogènes, avec une forte composante mésenchymateuse et à les réinjecter, comme dans l’étude précédente, par voie intracoronaire(3). Ici encore, les résultats sont jugés positifs par les auteurs, même si certains s’interrogent sur le fait que le bénéfice, établi par l’IRM sous forme d’une réduction de la zone nécrosée, ne s’accompagne pas d’une amélioration de la fonction cardiaque. L’évaluation de cette stratégie va néanmoins se poursuivre sous la forme d’un plus vaste essai randomisé (ALLSTAR) qui utilisera le même type de cellules, mais d’origine allogénique. Le fait que les auteurs assument l’hypothèse de la disparition, par rejet, de ces cellules traduit bien que dans leur esprit, elles agissent plus ici encore par des effets paracrines que par la formation d’un tissu contractile.
Cette génération d’un nouveau myocarde ne semble en fait pouvoir être obtenue que par des cellules souches pluripotentes, prédifférenciées in vitro vers un phénotype cardiaque ou plus généralement mésodermique (avec alors possibilité d’une différenciation à la fois cardiaque et vasculaire) avant d’être transplantées. C’est cette approche qui explique l’intérêt porté aux cellules souches embryonnaires dérivées d’embryons très précoces (4-6 jours après la fécondation) conçus dans le cadre d’une aide à la procréation et ne faisant plus l’objet d’un projet parental. Leur utilisation clinique n’est plus un mythe puisque deux essais sont en cours :
- l’un a utilisé ces cellules prédifférenciées en oligodendrocytes pour réparer des lésions traumatiques de la moelle épinière (il a été interrompu pour des raisons financières) ;
- l’autre, qui se poursuit, cherche à traiter la dégénérescence maculaire par des cellules souches embryonnaires prédifférenciées en progéniteurs rétiniens.
Deux défis majeurs
Dans le cas du cœur, la différenciation des cellules souches embryonnaires en progéniteurs cardiaques est aujourd’hui un processus assez bien maîtrisé, et ces cellules sont, à ce jour, les seules capables d’une intégration électromécanique, prérequis à une contribution réelle à la fonction contractile, du moins dans des conditions expérimentales(4). Toutefois, indépendamment des aspects éthiques qu’une loi, unique au monde et promulguée par le gouvernement précédent, a finalement réglés (cette recherche est interdite, mais peut être autorisée !), l’utilisation thérapeutique des cellules souches embryonnaires pose deux défis majeurs :
- Le premier est lié au risque tumoral si des cellules incomplètement prédifférenciées, c’est-à-dire encore pluripotentes et donc capables d’une prolifération incontrôlée, venaient à être greffées, d’où l’importance de l’étape de tri pour ne conserver qu’une population pure de progéniteurs.
- Le second découle du caractère allogénique de ces cellules et donc du risque de leur rejet ; une recherche importante est aujourd’hui consacrée au développement de stratégies d’immunomodulation qui permettraient d’éviter un lourd traitement immunosuppresseur dont on connaît les risques ; dans ce domaine, la possibilité d’induire une tolérance immunitaire (déjà démontrée pour la transplantation d’organes solides) par la brève administration d’anticorps (anti-CD3 ou anti-CD4 et CD8) apparaît comme l’une des options les plus attractives pour orienter favorablement le rapport bénéfice/risque.
Les cellules pluripotentes induites
Une abondante littérature est aussi consacrée aux cellules pluripotentes induites (iPS) qui sont des cellules adultes reprogrammées à un état pseudo-embryonnaire avant d’être redifférenciées dans la direction souhaitée. Leurs avantages principaux sont d’éviter le débat éthique sur l’embryon et, en principe (car cela est discuté), les problèmes immunitaires puisque ces cellules peuvent être prélevées chez le patient lui-même (fibroblastes cutanés, voire follicules pileux). Toutefois, leur application clinique potentielle se heurte à des obstacles importants, et notamment le risque d’aberrations génétiques liées au processus de reprogrammation, même si l’on peut s’affranchir des vecteurs viraux initialement utilisés pour transfecter les cellules avec les facteurs nécessaires pour les ramener à un état pseudo-embryonnaire. Aussi s’accorde-t-on à reconnaître que ces iPS sont aujourd’hui surtout utiles pour le criblage de médicaments ou la modélisation de certaines maladies, alors que leur application à la médecine régénérative reste plus incertaine et en tout cas sans doute lointaine.
Il convient enfin de souligner que tout comme dans le cas de l’infarctus au stade aigu, un problème général est ici le faible nombre de cellules qui survivent dans le tissu greffé. Cette observation explique l’importance de la recherche visant à améliorer la prise de greffe, principalement par la combinaison des cellules avec des biomatériaux permettant de « protéger » les cellules pendant le transfert et de créer, grâce à leurs propriétés physico-chimiques, un micro-environnement favorisant la prolifération et la différenciation des cellules tout en stimulant le développement de la vascularisation nécessaire à leur survie. Le cœur étant un organe anisotrope, c’est-à-dire dont la fonction est dépendante de l’orientation de ses fibres, ces matériaux ensemencés peuvent être « travaillés » avant leur implantation afin que les cellules soient déjà orientées en faisceaux et puissent former ainsi in vivo un néo-tissu capable de contribuer efficacement à la contraction. Il est donc vraisemblable que l’utilisation des techniques d’ingénierie tissulaire va améliorer l’efficacité de la thérapie cellulaire.
Vers une thérapie cellulaire sans cellules...
S’il reste difficile de prévoir encore quelle sera la place exacte de cette approche pour traiter certaines pathologies cardiaques, aiguës ou chroniques - seuls des essais complexes et coûteux apporteront une réponse -, on peut néanmoins espérer, au vu des moyens considérables attribués à cette recherche dans le monde, que l’utilisation de cellules trouvera une application thérapeutique en cardiologie, comme elle l’a trouvée avec succès dans le traitement des brûlures ou des hémopathies. Il n’est même pas inconcevable que s’il s’avérait, in fine , que les cellules agissent dans le cœur par des mécanismes exclusivement paracrines, on aboutisse un jour à une thérapie cellulaire... sans cellules, seuls étant administrés, tels des médicaments, les facteurs identifiés comme les plus cardioprotecteurs et sécrétés par des cellules maintenues en culture à des seules fins de production et non plus de greffe.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :