Coronaires
Publié le 14 fév 2014Lecture 10 min
Athérome ou vasospasme coronaire ?
F. PHAN, F. EL BUHALI, E. SALENGRO, Centre hospitalier intercommunal de Villeneuve-Saint-Georges
En 1959, Prinzmetal décrit un syndrome de douleur thoracique secondaire à une ischémie myocardique qui survenait préférentiellement au repos et qui était associée à un sus-décalage du segment ST à l’ECG. Ce syndrome, maintenant connu sous le nom d’angor de Prinzmetal ou d’angor spastique, peut entraîner un infarctus du myocarde ou des troubles du rythme ventriculaire graves. Cet angor de Prinzmetal peut survenir sur des artères coronaires athéromateuses ou non.
Avec l’introduction de la coronarographie par Sones et Shirney en 1959, le spasme coronaire est documenté angiographiquement pendant la phase aiguë dans les années 1970.
Prévalence
Il n’existe pas suffisamment de données épidémiologiques pour évaluer la prévalence des spasmes coronaires dans les pays caucasiens et américains. Cependant, la prévalence des spasmes coronaires semble diminuer dans les pays développés. Cela est lié, d’une part, à l’utilisation d’inhibiteurs des canaux calciques, qui sont le traitement du spasme coronaire, pour contrôler une hypertension artérielle et, d’autre part, à l’augmentation de l’utilisation de l’aspirine, des statines, des IEC ou ARA II, qui contribue aussi à la diminution du nombre de spasmes coronaires(1). En outre, les tests de provocation sont de moins en moins utilisés.
Physiopathologie
Le spasme coronaire résulte de deux composantes : la dysfonction endothéliale et l’hyperactivité des cellules musculaires lisses.
Dysfonction endothéliale
L’endothélium a un rôle majeur dans la régulation de la vasomotricité des artères coronaires par la libération d’agents vasodilatateurs, dont le principal est le NO (figure 1). Ainsi, une lésion endothéliale diminuerait la vasodilatation et favoriserait le spasme coronaire en réponse à un stimulus vasoconstricteur : en effet, l’acétylcholine engendre une vasodilatation en libérant le NO de l’endothélium des artères coronaires des sujets sains alors qu’elle provoque une vasoconstriction chez les sujets présentant de l’athérosclérose coronaire(2). En outre, d’autres stimuli vasoactifs tels que la sérotonine et l’histamine engendrent une vasodilatation en induisant un relargage de NO par l’endothélium, mais peuvent aussi engendrer une vasoconstriction en stimulant directement les cellules musculaires lisses. Ainsi, en cas de dysfonction endothéliale, leur libération dans la paroi artérielle peut mener à une vasoconstriction et/ou à un spasme coronaire.
Figure 1. Régulation des artères coronaires par la libération des agents vasodilatateurs.
Par ailleurs, les nitrates, dont la nitroglycérine, sont des agents vasodilatateurs en étant converti in vivo en NO. Les coronaires spastiques sont particulièrement sensibles aux effets vasodilatateurs des nitrates(3). Il est possible que l’hypersensibilité de ces coronaires au NO soit liée à une diminution de l’activité endogène dans ces artères(4). Le NO est synthétisé à partir de la L-arginine par la voie des NO synthases, voie spécifiquement bloquée par la L-monométhyl- arginine (L-NMMA)(5).
Expérimentalement, le diamètre des artères coronaires diminue en réponse à l’infusion intracoronaire de L-NMMA chez les sujets contrôles, alors qu’il ne varie pas de manière significative chez les patients avec coronarospasme(6). Ces observations indiquent que le NO est libéré à l’état basal et participe à la tonicité vasculaire chez les sujets normaux et que cette même activité est diminuée chez les sujets avec coronarospasme. Le NO est aussi connu pour inhiber la production d’endothéline I et l’angiotensine II, qui sont de puissants vasoconstricteurs et des facteurs de prolifération des cellules musculaires lisses(7).
Polymorphisme de la NO synthase
Le NO endothélial est synthétisé par la NO synthase exprimée exclusivement dans l’endothélium. Il a été montré que les polymorphismes de Glu298Asp dans l’exon 7 et T-786C dans la région 5’ du gène e-NOS sont significativement associés à un risque plus élevé de spasme coronaire(8). Qui plus est, non seulement les artères coronaires mais aussi les artères périphériques présentent ce déficit de l’activité en NO(9).
Hyperactivité primaire des cellules musculaires lisses
L’hyperactivité locale des cellules musculaires lisses a été mise en évidence par l’observation que les stimuli vasoconstricteurs induisant le spasme coronaire dans le segment coronaire des patients présentant un angor spastique sont incapables d’induire un spasme coronaire dans d’autres segments coronaires de ces mêmes patients ou chez les patients présentant un angor d’étiologie différente(10).
Mécanisme de la contraction musculaire
(figure 2)
Figure 2. Mécanisme de la contraction musculaire.
La contraction et la relaxation musculaires sont régulées par la chaîne légère de la myosine kinase et par la chaîne légère de la myosine phosphatase au travers de mécanismes de phosphorylation et de déphosphorylation de la chaîne légère de la myosine(11). La phosphorylation de la chaîne légère de la myosine et donc l’induction d’une contraction musculaire nécessitent une augmentation de la concentration du calcium intracellulaire. Ainsi, le complexe Ca2+/calmoduline va activer la chaîne légère de la myosine kinase qui, à son tour, va phosphoryler la chaîne légère de la myosine, engendrant ainsi la contraction musculaire(12). En outre, le mécanisme physiologique de la contraction des cellules musculaires lisses engendré par la sensibilisation au calcium intracellulaire dépend de l’inhibition de la chaîne légère de la myosine phosphatase par la voie Rho et son sous-effecteur ROCK (figure 3) ; ce qui va permettre une augmentation de la phosphorylation de la chaîne légère de la myosine et donc la contraction musculaire(13). Le spasme coronaire peut être visualisé comme une hypercontraction des cellules musculaires lisses stimulée par une augmentation de la concentration en calcium intracellulaire. On comprend donc le rôle des inhibiteurs calciques dans le traitement du spasme coronaire. Par ailleurs, dans les modèles expérimentaux porcins, l’administration intra-coronaire de fasuldile et d’hydroxyfasuldile (inhibiteurs spécifiques des ROCK) inhibe le spasme coronaire(14).
Figure 3. Inhibiteur de la chaîne légère de la myosine phosphatase conduisant à la contraction musculaire.
Étiologies de l’hyperactivité des cellules musculaires lisses coronaires
Les facteurs de risque cardiovasculaire communs ne semblent pas associés significativement au spasme coronaire, exception faite pour le tabac. En effet, les patients tabagiques actifs constituent ~ 75 % des patients avec un angor en dehors de l’athérosclérose(15). La physiopathologie reste méconnue. De plus, la consommation et l’abus de substances (telles que la cocaïne, la marijuana, les amphétamines, le 5-FU, les triptans, etc.) peuvent provoquer ou favoriser la survenue du spasme coronaire(16).
Stress oxydatif
Les radicaux oxygénés causent des lésions au niveau endothélial des artères et dégradent le NO, favorisant ainsi la vasoconstriction. Le dosage des marqueurs du stress oxydant est augmenté et les concentrations sanguines d’antioxydants comme la vitamine E sont diminuées chez les patients avec angor spastique.
Clinique
Rythme circadien
Le spasme coronaire survient au repos, préférentiellement entre minuit et au petit matin(17).
Ainsi, il existe donc un rythme circadien. Il est connu que les cardiopathies ischémiques et les morts subites surviennent préférentiellement le matin, moment auquel la tonicité des cellules musculaires lisses est la plus importante(18). Les causes du rythme circadien des spasmes coronaires méritent d’être élucidées : le système nerveux autonome semble impliqué du fait que l’injection intracoronarienne d’acétylcholine, le neurotransmetteur du système nerveux parasympathique, provoque un spasme(19). Ce dernier peut aussi être induit par la stimulation des récepteurs α-adrénergiques(20). Néanmoins, le rôle du système nerveux autonome n’est pas clairement établi puisque des cas de spasme coronaire ont été décrits après dénervation cardiaque ou de transplantation cardiaque(21). La production circadienne d’hormones telles que le cortisol, la vasopressine, la mélatonine, la GH, l’insuline et les cytokines inflammatoires (TNF α ou IL-1) peut être liée à la physiopathologie du spasme.
Symptômes et modifications ECG
La présentation clinique typique associe une douleur thoracique et une modification du segment ST.
La sémiologie de la douleur thoracique est similaire à celle d’un syndrome coronarien aigu. Il est à noter que les ischémies myocardiques secondaires à un coronarospasme sont souvent silencieuses. En effet, l’incidence des ischémies myocardiques silencieuses est deux fois plus élevée que celles des ischémies symptomatiques(22).
Les modifications ECG incluent une élévation ou une dépression du segment ST, une onde T pointue ou une augmentation de son amplitude. Une onde U négative peut apparaître au début ou à la fin de l’attaque. Une dépression du segment ST, qui s’observe dans le cas de spasme coronaire moins sévère, une coronaire bouchée mais avec collatérales perméables ou une petite artère occluse signent une ischémie myocardique moins sévère (sous-endocardique) par rapport à une élévation du segment ST, qui signe une ischémie myocardique transmurale.
Plusieurs formes d’arythmies peuvent apparaître : les arythmies ventriculaires surviennent plus souvent lorsque le susdécalage du ST intéresse le territoire antérieur, alors que les bradyarythmies apparaissent plus souvent quand le sus-décalage du ST intéresse le territoire inférieur. Les arythmies létales comme la tachycardie/fibrillation ventriculaire et les BAV complets surviennent en cas de spasmes intéressant plusieurs coronaires(22). Il existe une bonne corrélation entre l’incidence des arythmies et l’importance de l’élévation du ST.
Facteurs favorisant
- Facteurs physiologiques : stress mental ou physique(23), exposition au froid(24), manœuvre de Valsalva et hyperventilation, déficit en magnésium(25).
- Agents pharmacodynamiques : catécholamines (épinéphrine, norépinéphrine, dopamine, dobutamine), parasympathomimétiques (acétylcholine), anticholinestérase, sérotonine, consommation de cocaïne, de tabac et d’alcool.
Facteurs de risque
- Homme > 50 ans (26).
- Femme ménopausée : le spasme survient rarement chez les femmes en âge de procréer, excepté pour celles présentant un tabagisme actif, car les œstrogènes jouent un rôle d’antioxydant(26).
- Tabagisme actif : en augmentant le stress oxydatif et en dégradant le NO(26).
- CRP ultrasensible élevée(27).
- Remnant lipoprotéine élevé(28).
- Syndrome de Raynaud.
- Asthme.
- Migraine.
Diagnostic
Une suspicion de spasme coronaire justifie une coronarographie pour détecter une plaque d’athérome sous-jacent.
Le diagnostic de certitude du spasme coronaire est angiographique et fait appel à des tests de provocation. En l’absence de sténose coronaire significative, le diagnostic de spasme est affirmé par la positivité d’un test au méthergin. Les contre-indications sont : lésions instables, sténose du tronc commun, multiples lésions sévères. L’injection se fait par voie intraveineuse durant la coronarographie et la levée du spasme coronaire est assurée par de fortes doses de dérivés nitrés intracoronaires. L’angor de Prinzmetal survient préférentiellement entre minuit et 8 heures du matin. Le diagnostic du spasme est réalisé par l’enregistrement de la crise au Holter ECG d’une grande onde de sus-décalage du segment ST englobant l’onde T. Cette anomalie en rapport avec l’occlusion coronaire aiguë est transitoire et n’est généralement pas suivie de nécrose myocardique.
Traitement
À la phase aiguë, le spasme peut être levé par l’administration sublinguale de dérivés nitrés. Parfois, l’administration intraveineuse ou intracoronaire est nécessaire dans les cas réfractaires.
Le traitement de fond du spasme coronaire repose sur la prescription d’inhibiteurs calciques vasodilatateurs à fortes doses. En effet, les bloqueurs des canaux calciques inhibent l’entrée du calcium dans les cellules musculaires lisses, favorisant ainsi la vasodilatation. Il est important de couvrir les périodes du nycthémère pendant lesquelles surviennent les crises, d’où l’intérêt de prendre ces médicaments le soir.
Les dérivés retards sont également intéressants. Cependant, en pratique clinique, une fenêtre thérapeutique de 8 h est recommandée.
Les inhibiteurs de la voie des Rho et ROCK semblent intéressants dans le traitement du spasme coronaire.
En pratique
Le spasme coronaire, qui était initialement décrit chez les patients avec des artères coronaires saines, survient fréquemment sur les artères athéromateuses, aussi bien sur les plaques jeunes que sur les anciennes(29).
Le test au méthergin semble donc également pertinent à réaliser dans le cadre de douleurs thoraciques évocatrices chez des coronariens avérés chez qui la coronarographie n’a pas mis en évidence de resténose et/ou de progression lésionnelle significative.
Cas clinique
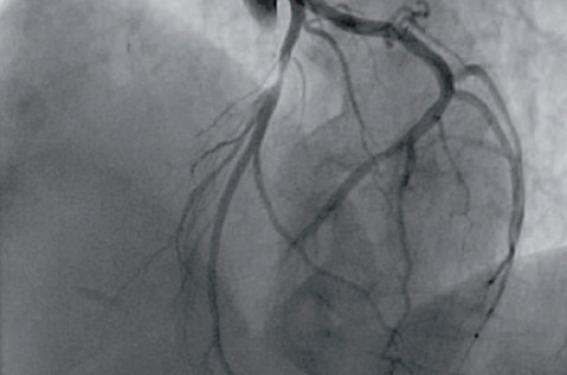
Une femme de 58 ans est transférée en salle de coronarographie pour des douleurs thoraciques plus ou moins épigastriques ayant débuté la veille de l’admission après qu’une échocardiographie a objectivé la survenue brutale d’une akinésie apicale concomitamment à la douleur. Ses principaux antécédents associaient un stripping bilatéral des varices et une phlébite superficielle. Ses facteurs de risque cardiovasculaire se limitaient à un tabagisme actif à 40 PA. L’ECG retrouvait une ischémie biphasique antéro-septo-latérale. La troponine T US était alors positive à 30 ng/l. La coronarographie mettait en évidence une sténose serrée de l’IVA moyenne, monotronculaire, dilatée dans la foulée avec un stent actif Xience® (Abbott Vascular) 2,75 x 15 mm (figure 4). L’état hémodynamique étant stable, elle quitte le service deux jours après son admission avec le traitement cardioprotecteur associant la double antiagrégation plaquettaire par Kardégic® et Brilique®, 2,5 mg de Cardensiel®, 2,5 mg de Triatec®, 10 mg de Crestor® et de la trinitrine en cas de nécessité. La patiente est avertie de l’impérativité du sevrage tabagique.
Deux semaines plus tard, elle est à nouveau hospitalisée pour récidive de douleur thoracique rétrosternale, de repos, trinitrosensible, irradiant au bras gauche. L’observance thérapeutique est bonne, mais le sevrage tabagique n’est pas obtenu. L’examen clinique est sans particularité. Le tracé ECG s’inscrit en rythme sinusal sans trouble de la repolarisation. La troponine T US est à 27 ng/l. La coronarographie de contrôle montre l’absence de resténose intrastent et de progression lésionnelle. En revanche, le test au méthergin est positif de manière diffuse avec, en particulier, un spasme sub-occlusif sur l’IVA (figure 5). Une bithérapie antispastique par Isoptine LP 240® + Corvasal® 2 mg x 3 est alors introduite, alors que les bêtabloquants sont interrompus.
La patiente est revue en consultation deux mois plus tard et ne rapporte pas de récidive douloureuse sous traitement.
Figure 4. Sténose serrée de l’IVA moyenne.
Figure 5. Test de méthergin positif avec spasme sub-occlusif de l’IVA.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :