Thérapeutique
Publié le 14 oct 2014Lecture 15 min
Gestion périopératoire des anticoagulants oraux directs
A. GODIER*/**, I. GOUIN-THIBAULT**/***, N. ROSENCHER°, P. ALBALADEJO°° Groupe d’intérêt en hémostase périopératoire (GIHP) *Service d’anesthésie-réanimation, Fondation ophtalmologique Adolphe de Rothschild, Paris. **INSERM UMR-S1140, Université Paris Desc
Les premiers anticoagulants oraux directs (AOD) ont été commercialisés en 2008. Leur prescription va croissant puisque les AOD représentaient en décembre 2013 30 % des anticoagulants oraux prescrits en France, selon les données de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM). Trois AOD sont disponibles en France en 2014 : un antithrombine, le dabigatran etexilate (Pradaxa®, Boehringer-Ingelheim), premier arrivé, puis deux anti-Xa directs, le rivaroxaban (Xarelto®, Bayer) et l’apixaban (Eliquis®, BMS-Pfizer).
Comme tous les antithrombotiques, ils exposent à un risque hémorragique, qui implique une prise en charge spécifique lors d’un accident hémorragique ou en périopératoire d’une chirurgie programmée ou urgente. Ce texte discute les différents aspects de la prise en charge périopératoire des patients traités par AOD au long cours et présente les propositions faites par le Groupe d’intérêt en hémostase périopératoire (GIHP)(1-4) pour aider le clinicien dans sa pratique, en attendant que des recommandations puissent être faites à partir de données robustes.
Risque hémorragique des AOD
Les anticoagulants oraux directs exposent, comme tous les antithrombotiques, à des complications hémorragiques. Les essais pivots qui ont conduit à l’obtention des autorisations de mise sur le marché ont montré que le risque d’hémorragie grave persistait avec les AOD.
L’incidence des hémorragies graves associées au rivaroxaban est comparable à celle des AVK, que ce soit dans l’étude ROCKET- AF(5) de prévention des accidents vasculaires cérébraux et des embolies systémiques chez les patients traités pour une fibrillation auriculaire, ou dans l’étude EINSTEIN-DVT(6), dans la prévention des récidives après thrombose veineuse profonde. Dans l’étude EINSTEIN-PE(7), pour la prévention des récidives après embolie pulmonaire, le rivaroxaban est associé à une réduction des hémorragies graves, comparé aux AVK.
L’apixaban, quant à lui, est associé à une diminution des hémorragies graves dans ARISTOTLE(8), essai mené pour la prévention des accidents vasculaires cérébraux et des embolies systémiques chez les patients traités pour une fibrillation atriale.
Dans RELY(9) comme dans RECOVER(10), les deux essais ayant évalué l’efficacité et la sécurité du dabigatran, l’un pour la prévention des accidents vasculaires cérébraux et des embolies systémiques chez les patients traités pour une fibrillation atriale et l’autre pour la prévention des récidives après thrombose veineuse profonde, l’incidence des complications hémorragiques majeures était comparable avec le dabigatran (150 mg 2 fois par jour) ou avec les AVK, mais diminuées de 20 % avec le dabigatran 110 mg.
Cependant, les hémorragies graves n’ont pas toutes les mêmes conséquences et il faut noter que dans toutes les études de phase III concernant la fibrillation atriale, les AOD réduisent l’incidence des hémorragies intracrâniennes.
Prise en charge d’une hémorragie associée aux AOD
Absence d’antidote commercialisé
Des antagonistes des facteurs Xa et IIa sont en développement. Les résultats des premières études sont prometteurs, mais ces molécules ne seront pas commercialisées avant encore quelques années. Un facteur Xa recombinant a ainsi montré qu’il pouvait représenter un antidote potentiel pour les inhibiteurs du Xa(11). Il s’agit d’une forme tronquée de facteur Xa avec un site catalytique inactif et une haute affinité pour les inhibiteurs du facteur Xa. L’antidote du dabigatran est un anticorps spécifique de l’AOD, de forte affinité, et présentant des similarités structurelles avec la thrombine(12). Cet anticorps est dénué d’activité sur les tests de coagulation et un essai clinique est actuellement en cours en France.
Dialyse
L’hémodialyse n’a d’intérêt que pour le dabigatran. Sa liaison aux protéines plasmatiques est relativement faible (35 %). Une étude de phase 1, réalisée sur 7 patients dialysés chroniques a montré que 4 heures d’hémodialyse réalisée avec un débit sanguin de 200 ou de 400 ml/ minute permettait de réduire la concentration de dabigatran de 49 et 59 %, respectivement(13). La fin de la dialyse était marquée par une redistribution du dabigatran, qui était néanmoins peu importante (16 %).
Charbon actif
L’utilisation de charbon actif permet de limiter l’absorption des AOD et semble avoir un effet prolongé. Une étude réalisée chez des volontaires sains montre que l’administration de charbon jusqu’à 6 heures après la prise orale d’apixaban permet encore de réduire les concentrations plasmatiques(14).
Agents hémostatiques
Trois agents hémostatiques non spécifiques sont proposés en cas d’hémorragie grave associée aux AOD. Il s’agit des concentrés de complexe prothrombinique non activé (CCP, correspondant aux anciens PPSB) ou activé (Factor Eight Inhibitor Bypassing Activity FEIBA®) et du facteur VII active recombinant (rFVIIa). Les CCP et le rFVIIa ont été les premiers à être suggérés ; à présent, les concentrés activés font de plus en plus partie des recommandations internationales(15-18), séduisants par l’association de facteurs de coagulation sous forme active et non active. Néanmoins, l’efficacité de ces agents n’est pas établie. Ils ont été évalués chez l’animal et le volontaire sain. F.M. Lee et coll. ont réalisé une analyse détaillée des 11 études animales et des 2 essais chez l’homme ayant évalué l’efficacité de ces agents hémostatiques pour reverser les AOD(19). Selon l’agent hémostatique et l’AOD testés, on observe une correction plus ou moins marquée de certains paramètres de tests d’hémostase spécifiques, tandis que chez l’animal les résultats sur la réduction du saignement sont contradictoires, rendant difficile toute conclusion formelle. De plus, ces agents hémostatiques sont coûteux et exposent à un risque thrombotique potentiel, non évalué dans ces situations spécifiques. Le rFVIIa en particulier s’associe à des complications thrombotiques, surtout artérielles, d’autant plus fréquentes que les sujets sont âgés(20). Pour ces raisons, en cas de tentative d’antagonisation, le choix se porte aujourd’hui plutôt vers les CCP activés ou non.
Synthèse de la prise en charge d’une hémorragie associée aux AOD
En pratique, devant un accident hémorragique associé aux AOD, il faut en premier lieu distinguer une hémorragie grave, qui nécessite une prise en charge urgente et spécifique, d’une hémorragie non grave, qui sera d’abord prise en charge de façon purement symptomatique. Un dosage spécifique de l’AOD est réalisé avec recueil précis de l’heure de la dernière prise, la dose, le nombre de prises par jour et la fonction rénale du patient, évaluée par la formule de Cockcroft and Gault. Ensuite, les mesures conventionnelles non spécifiques à appliquer en cas de saignement sont mises en œuvre : compression mécanique, intervention chirurgicale ou endoscopique, embolisation, transfusion (et interruption du traitement). L’antagonisation du traitement par CCP ou FEIBA® est tentée sans délai en cas d’hémorragie dans un organe critique, ou en cas de concentration d’AOD élevée dans les autres types d’hémorragies graves, si le traitement conventionnel ne suffit pas(1,2). Le GIHP a proposé des modalités de prise en charge des hémorragies associées aux AOD détaillées dans la figure 1.
Figure 1. Prise en charge d’une hémorragie associée aux AOD.
Gestion périopératoire des AOD
Les patients traités au long cours par AOD et nécessitant un geste invasif sont de plus en plus nombreux. Leur prise en charge découle, comme pour tous les antithrombotiques, de la mise en balance de deux risques : le risque thrombotique du patient, augmenté par l’arrêt des AOD, et le risque hémorragique de la chirurgie, augmenté par la poursuite des AOD. La mise en balance de ces deux risques permet de déterminer la conduite à tenir optimale parmi 4 possibilités théoriques : poursuite des AOD, arrêt des AOD sans relais, arrêt des AOD avec relais, prise en charge en urgence. Mais cette mise en balance est difficile et ne repose aujourd’hui sur aucune recommandation forte car les données publiées sont encore peu nombreuses et notre expérience de prise en charge de ces patients est encore fragile. Le GIHP a fait des propositions de prise en charge périopératoire de ces patients qui dépendent du degré d’urgence et de l’évaluation des risques hémorragiques et thrombotiques(3,4). Elles intègrent aussi les modalités d’arrêt, de relais éventuel et de reprise.
Évaluation du risque hémorragique
Cette évaluation a été simplifiée par les Recommandations pour la pratique clinique (RPC) des AVK(21). En effet, ces RPC distinguent deux types de situations : les situations à faible risque hémorragique, où la chirurgie peut être réalisée sans arrêt des AVK, et les situations à risque hémorragique élevé, qui nécessitent de corriger la coagulation avant la réalisation de la chirurgie afin de prévenir les accidents hémorragiques.
Le risque hémorragique dépend à la fois du patient et de la procédure :
- le risque hémorragique lié au patient est fonction de ses antécédents, de l’existence d’une coagulopathie congénitale ou acquise et de la prise concomitante d’autres médicaments interférant avec l’hémostase ;
- les procédures à faible risque hémorragique correspondent aux procédures induisant des saignements peu fréquents, de faible intensité et aisément contrôlés, ce qui inclut la chirurgie cutanée, la chirurgie de la cataracte, les actes de rhumatologie de faible risque hémorragique et certains actes de chirurgie bucco-dentaire et d’endoscopie digestive, etc. Les autres procédures invasives sont donc considérées à risque hémorragique modéré ou élevé.
Évaluation du risque thrombotique
Cette évaluation a été elle aussi simplifiée par les RPC, en identifiant deux types de risque thrombotique lié au patient : le risque élevé ou le risque modéré (un patient traité par anticoagulant présentant, par définition, un risque thrombotique). Cette évaluation a pour principal but d’estimer le risque thrombotique d’une interruption de quelques jours des AOD afin de déterminer la nécessité ou non d’un relais par un autre anticoagulant, plus maniable ou mieux connu. Le relais, réalisé en cas de risque élevé, permettrait de réduire la fenêtre sans anticoagulant et donc le risque thrombotique. Brièvement, le risque est ainsi défini par les RPC :
- chez les patients porteurs d’une FA, le risque thromboembolique est élevé en cas d’antécédent d’accident ischémique cérébral, transitoire ou permanent, ou d’embolie systémique. Dans les autres cas, le patient n’est pas considéré comme à haut risque ;
- dans le cadre de la maladie thromboembolique veineuse, les patients sont à haut risque thromboembolique en cas d’accident (thrombose veineuse profonde et/ou embolie pulmonaire) datant de moins de 3 mois, ou de maladie thromboembolique récidivante idiopathique (nombre d’épisodes ≥ 2, au moins un accident sans facteur déclenchant). Si l’accident date de moins d’un mois, le risque est très élevé ;
- on notera que si les patients porteurs d’une valve mécanique sont tous considérés à risque thrombotique élevé, ils ne sont néanmoins pas concernés par les AOD.
Prise en charge pour une chirurgie programmée à risque hémorragique élevé
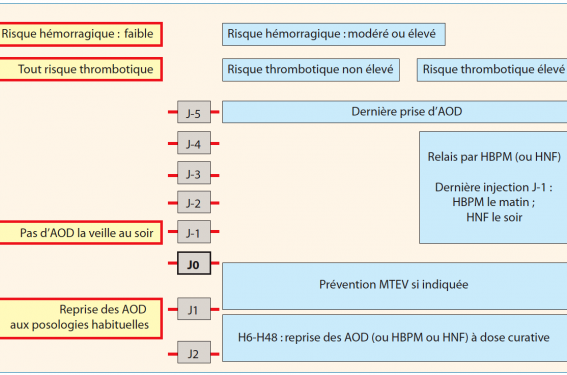
Pour une chirurgie programmée à risque hémorragique élevé, les AOD sont arrêtés. Reste à discuter le délai d’arrêt et la pertinence d’un relais. Les modalités proposées par le GIHP sont détaillées dans la figure 2.
Figure 2. Prise en charge d’un patient traité par AOD à dose curative et nécessitant un acte invasif programmé.
Délai d’arrêt
Les caractéristiques pharmacocinétiques théoriques des AOD, particulièrement leur demi-vie courte, pourraient théoriquement permettre d’envisager un arrêt très bref en préopératoire, comme le proposent d’ailleurs les résumés des caractéristiques des produits des différents AOD, puisque 75 % du produit seraient éliminés après environ 24 h et 87 % après 36 h. Cependant, cette option se heurte à plusieurs écueils :
- les demi-vies diffèrent d’un AOD à l’autre et surtout il existe une variabilité interindividuelle de la demi-vie et de la concentration circulante de l’AOD en fonction du sexe, de l’âge et d’un poids « extrême », de la fonction rénale et hépatique, et des comédications(22,23). Cette variabilité ne permet donc pas de prédire les concentrations résiduelles après un arrêt bref. L’amendement survenu au cours de RELY, l’essai clinique ayant montré l’intérêt du dabigatran comparé aux AVK dans la FA, en est l’illustration : initialement le délai d’arrêt du dabigatran avant chirurgie était de 24 h. Par la suite, ce délai a été conservé pour les patients à faible risque hémorragique ; pour ceux présentant un fort risque hémorragique, ce délai a été allongé, allant de 2 à 3 jours à plus de 5 jours(24). Le motif de l’amendement n’est pas précisé mais la survenue d’accidents hémorragiques semble l’hypothèse la plus probable ;
- aujourd’hui, en pratique courante, le dosage spécifique de l’AOD n’est pas réalisable systématiquement dans tous les centres, et pour tous les patients, afin de connaître la concentration initiale et prévoir la décroissance ou bien pour vérifier juste avant l’acte invasif programmé que la concentration est inférieure au seuil de sécurité hémostatique ;
- le seuil de sécurité hémostatique, qui correspond à la concentration plasmatique résiduelle acceptable pour un geste invasif à risque hémorragique, est mal connu. Le seuil de 30 ng/ml a été proposé pour dabigatran et rivaroxaban mais n’a pas été validé ;
- aucun moyen de neutralisation rapide n’est disponible, à l’image de la vitamine K pour les AVK, si le seuil de sécurité hémostatique n’était pas atteint la veille de l’intervention. Ceci implique de reporter l’acte et désorganise alors les soins et l’activité chirurgicale ;
- en cas d’hémorragie peropératoire, le traitement spécifique est mal établi : il n’y a pas d’antidote et l’efficacité des agents hémostatiques est incertaine.
Pour toutes ces raisons, n’arrêter que brièvement l’AOD sur la foi d’une spéculation pharmacocinétique ne semble pas la meilleure prise en charge parce qu’elle expose une proportion de patients à des complications hémorragiques, non prévisibles et non contrôlables. En l’état actuel de nos connaissances et de nos moyens, la sécurité d’une procédure à risque hémorragique n’est garantie que par sa réalisation après l’élimination complète de l’anticoagulant chez tous les patients. Ceci n’est possible que si le délai d’arrêt est suffisant pour l’ensemble des patients, quelles que soient leurs caractéristiques propres interférant avec la pharmacocinétique. Un arrêt 3 à 4 jours avant l’intervention, comme pour les AVK, pourrait remplir ces conditions. C’est ainsi que le GIHP propose que la dernière prise d’AOD ait lieu à J-5 avant une chirurgie programmée. Ces propositions sont différentes des indications proposées dans les RCP ou dans le document de « Guidance de l’EHRA ».
Relais périopératoire
Le relais périopératoire consiste à prescrire des héparines pendant la période où les AOD sont interrompus. Il a pour but de réduire le risque thrombotique du patient, bénéfice qui doit être mis en balance avec le risque hémorragique associé. En effet, l’analyse des 863 interventions chirurgicales du registre de Dresde, réalisées chez des patients traités par AOD au long cours, a montré que les patients qui avaient eu un relais périopératoire par des héparines n’avaient pas moins de complications cardiovasculaires que ceux qui n’avaient pas eu de relais mais développaient plus d’hémorragies majeures(25). Cette analyse confirmait avec les AOD les données déjà observées avec les AVK. En effet, une métaanalyse des 34 études ayant évalué les complications périopératoires thrombotiques et hémorragiques chez des patients traités par AVK a conclu que le relais par HBPM ne réduisait pas les complications thrombotiques mais était associé à une augmentation des hémorragies majeures(26). Ces données suggèrent de réserver le relais par des héparines aux patients exposés à un risque thrombotique très élevé. Le GIHP a donc proposé de recourir aux schémas recommandés pour les AVK :
- un risque thromboembolique élevé conduit à réaliser un relais par des héparines, à dose curative, débutées au moins 24 heures après l’arrêt des AOD ;
- un risque thromboembolique faible conduit à arrêter les AOD dans le même délai mais sans relais ;
- les AOD sont repris à dose curative dans les 6 à 48 heures postopératoires selon le risque hémorragique et le risque thromboembolique. Si le risque hémorragique est élevé, un autre anticoagulant peut être préféré. En absence de disponibilité de la voie orale, les héparines peuvent être utilisées. Si les anticoagulants ne sont pas repris à dose curative dès le premier soir, alors dans les situations où elle est indiquée, une thromboprophylaxie est réalisée selon les modalités habituelles.
Prise en charge pour une chirurgie programmée à faible risque hémorragique
Le raisonnement peut se faire par analogie avec les AVK : les procédures à faible risque hémorragique sont réalisables sans arrêt des anticoagulants chez les patients traités par AVK, si leur INR est compris en 2 et 3. En cas d’hémorragie imprévue, les concentrés de complexe prothrombinique et la vitamine K permettent de les antagoniser(21). Néanmoins, pour les AOD, il n’y a pas de dosage de routine et les valeurs d’AOD correspondant à une éventuelle accumulation ne sont pas précisément définies, et il n’y a pas d’antidote en cas d’hémorragie imprévue. Le GIHP propose donc de ne pas prendre l’AOD le soir de la veille de la chirurgie et de le reprendre aux posologies habituelles le lendemain, afin de réduire la concentration plasmatique au moment du geste (figure 2). Des recommandations spécifiques pour la chirurgie ophtalmologique, SFAR-SFO, pour l’endoscopie digestive, GIHP-SFED et la chirurgie odontologique, SFAR-SFCO, sont disponibles (site de la SFAR) ou en cours d’élaboration.
Prise en charge pour une chirurgie semi-urgente
Lorsque la chirurgie est semi-urgente (fracture du col du fémur, talcage pleural, etc.), connaître la concentration initiale de l’anticoagulant permet de prévoir le délai nécessaire pour passer sous le seuil de sécurité et décider s’il est possible d’attendre en fonction du rapport bénéfice/risque. Les modalités proposées par le GIHP sont détaillées dans la figure 3.
Figure 3. Prise en charge d’un patient traité par AOD pour une chirurgie semi-urgente à risque hémorragique.
Prise en charge pour une chirurgie urgente
Les AOD ne doivent pas retarder une chirurgie urgente (péritonite, fracture ouverte, etc.). La réalisation d’un dosage spécifique de l’AOD permet de guider la prise en charge (figure 4) :
- si la concentration d’AOD est sous le seuil de sécurité hémostatique, aucun traitement spécifique n’est nécessaire, et si une hémorragie survient en cours d’intervention, elle n’est pas liée aux AOD. Par conséquent, il n’y a pas lieu d’administrer des agents hémostatiques dans le but de neutraliser les AOD. Le seuil de sécurité de 30 ng/ml a été proposé pour le dabigatran et le rivaroxaban. Pour l’instant il n’est pas défini pour l’apixaban mais il est raisonnable de penser qu’une concentration d’apixaban inférieure à 30 ng/ml ne confère pas un risque hémorragique surajouté ;
- si la concentration est élevée, alors il existe un sur-risque hémorragique potentiel lié aux AOD. On considère qu’une concentration supérieure à 400 ng/ml confère un risque hémorragique majeur. Néanmoins, même réalisée avec une concentration élevée d’anticoagulant, la chirurgie ne se complique pas systématiquement d’une hémorragie. Par conséquent, puisque l’efficacité des agents hémostatiques n’est pas démontrée et qu’ils exposent potentiellement à des complications thrombotiques, il est proposé de ne les administrer qu’en cas d’hémorragie avérée et non pas en prophylaxie, avant la chirurgie. Ceci implique une collaboration étroite avec les chirurgiens.
Figure 4. Prise en charge d’un patient traité par AOD pour une chirurgie urgente à risque hémorragique.
Le GIHP a proposé d’utiliser les tests d’hémostase usuels dans les situations où les dosages spécifiques ne sont pas disponibles. Il s’agit d’une approche grossière qui a pour seul objectif d’identifier la présence d’AOD et non de déterminer finement le niveau d’anticoagulation, ce qui n’est pas possible avec les tests standards. En effet, le TP et le TCA sont modifiés par le rivaroxaban et le dabigatran de façon non spécifique et variable en fonction des réactifs, de l’heure du prélèvement et d’un patient à un autre, tandis qu’ils sont très peu sensibles à l’apixaban, ce qui ne permet aucune interprétation de l’intensité de l’anticoagulation ni la recherche d’un surdosage. Cependant, l’association d’un résultat normal de TP et de TCA indique avec une probabilité suffisante pour la majorité des situations que la concentration résiduelle de dabigatran ou de rivaroxaban est faible, proche du seuil de sécurité hémostatique. Le GIHP a donc proposé qu’en situation d’urgence, chez un patient traité par rivaroxaban ou dabigatran, si les tests spécifiques ne sont pas disponibles, un TP normal associé à un TCA normal permet de conclure que la concentration résiduelle est très faible, rendant la chirurgie réalisable. Néanmoins, cette combinaison du TP et du TCA ne peut pas être utilisée pour l’apixaban. En effet, l’apixaban ne modifie que peu les tests d’hémostase usuels, par conséquent, le TP et le TCA peuvent être normaux alors même que le traitement curatif est équilibré(27).
Enfin, ces deux tests peuvent être anormaux alors même que les AOD sont éliminés si le patient présente des troubles de la coagulation liée à une pathologie associée, ce qui n’est pas rare en situation d’urgence (sepsis, hémorragie grave, etc.) et peut induire des erreurs de prise en charge. Enfin, les tests chromogéniques anti-Xa, tels que réalisés pour le dosage de l’activité anti-Xa de l’héparine ou des HBPM, et le temps de thrombine peuvent aider à la prise en charge car ils sont très sensibles à l’effet des anti-Xa et des anti-IIa respectivement. Ainsi, une activité anti-Xa HBPM ou HNF < 0,15 U/ml permet de conclure que la concentration résiduelle en apixaban ou en rivaroxaban est proche de 0, tandis qu’un temps de thrombine identique au témoin signe que la concentration résiduelle en dabigatran est proche de 0.
Conclusion
La prise en charge périopératoire des anticoagulants oraux directs n’est pas encore formalisée et, en absence de données publiées, elle repose essentiellement sur des avis d’experts. Les propositions du GIHP privilégient la sécurité et seront amenées à évoluer, en fonction des résultats des études à venir.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :