Publié le 14 nov 2014Lecture 16 min
La FFR (Fractional Flow Reserve) : une pratique courante ?
C. HURT, CHRU de Lille
Faut-il dilater une lésion coronaire que l’on vient de dépister ? C’est la question la plus fréquente posée en salle de cathétérisme. Seule la revascularisation des syndromes coronaires aigus garantit un bénéfice certain pour le patient. Mais les syndromes coronariens aigus ne représentent pas la majorité des patients sur la table d’opération et l’attitude à suivre face à une sténose coronaire fait rarement consensus lorsque la maladie coronaire est stable.
Les différentes formes d’évaluation et leurs limites
Plusieurs travaux ont rattaché le pronostic des patients au degré d’ischémie myocardique, mais il est important de préciser que cette corrélation a été démontrée par l’évaluation fonctionnelle du myocarde, l’ischémie ayant été prouvée par scintigraphie, sans avoir pris connaissance de l’anatomie coronaire des patients.
En salle de coronarographie existent plusieurs méthodes d’évaluation anatomiques créées afin de juger la sévérité d’une lésion coronaire. La plus fréquente est l’évaluation visuelle du degré de sténose d’une artère coronaire, mais la reproductibilité de cette technique est au mieux douteuse. Des moyens plus précis tels que le QCA (Quantitative Coronary Angiography), qui évalue la sévérité angiographique calculée à l’écran (mesure habituellement réalisée « à l’œil nu » par l’opérateur), ou bien différentes formes d’imagerie intracoronaire comme l’IVUS (Intravascular Ultrasound) ou l’OCT (Optical Coherence Tomography) se sont succédé pour offrir aux cardiologues interventionnels un arsenal d’évaluation diagnostique. Cependant, la corrélation entre évaluation anatomique et fonctionnelle est imparfaite. Raisonner sur le diamètre ou la notion d’une section de coupe artérielle minimale souhaitée (4 mm2 en IVUS) n’a pas de sens. Comment peut-on mettre au même plan la lumière d’un vaisseaux comme l’IVA proximale responsable de l’apport sanguin destiné à approximativement un tiers de la masse myocardique et la portion distale du même vaisseau ? Cela rend l’évaluation de l’imputabilité d’une ou de plusieurs lésions coronaires difficile en cas d’angor ou d’ischémie silencieuse.
Validations théoriques de la FFR
Depuis les années 1990, la FFR (Fractionnal Flow Reserve) a fait son apparition et permet d’évaluer le retentissement hémodynamique d’une sténose coronaire. La FFR ne mesure pas un degré de sténose, mais le rapport du flux réel sur le flux attendu dans un segment coronaire.
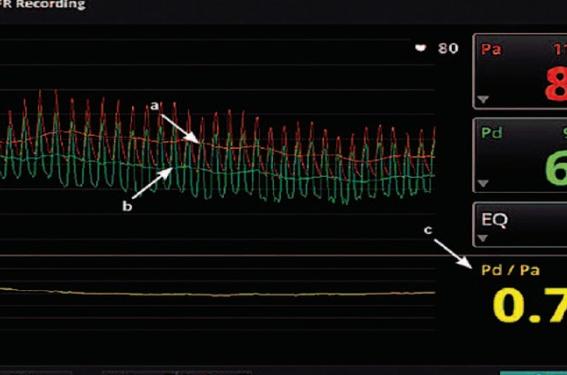
Un filament introduit dans l’artère est placé en distalité de la sténose et capte la pression coronaire d’aval alors que la pression aortique est recueillie par l’extrémité du cathéter à l’ostium de la coronaire. Le rapport de la pression distale sur la pression aortique est alors calculé. On évalue ainsi l’atténuation de pression causée par la sténose.
L’injection concomitante d’adénosine induit une hyperhémie, ce qui implique deux conséquences. Tout d’abord, en minimisant la résistance — ou plus précisément l’impédance — microcirculatoire coronaire, elle « ouvre les vannes », induisant un flux maximal dans l’ensemble de la coronaire. Par ailleurs, l’adénosine rend également la résistance constante et la loi d’Ohm (Pa = Qc x R) implique que le flux devient proportionnel à la pression.
La pression d’entrée à l’entrée de la coronaire (PAo) étant imposée par la pression régnant dans l’aorte et la résistance microcirculatoire R étant réduite à son minimum et devenue constante, le débit coronaire proximal s’exprime Qprox = PAo/R et Qdist = Pdist/R.
Le rapport initial qui divisait la pression distale à la sténose par la pression d’entrée de la coronaire (Pdist/PAo) devient ainsi le rapport d’un flux atténué par la sténose par le flux maximal attendu dans le segment artériel (Qdist/Qprox).
On notera sur le plan pratique que, conjointement à cette injection d’adénosine, de l’isosorbide dinitrate doit au préalable être injecté en intracoronaire afin de minimiser la résistance macrocirculatoire, bien qu’en réalité, la résistance induite par le vaisseau épicardique soit minimale (moins de 5 % de la résistance totale du réseau coronaire). De l’héparine est systématiquement injecté, comme c’est toujours le cas lorsqu’un guide intracoronaire est introduit.
Dans ces conditions, la FFR permet de mesurer de manière fiable et reproductible la conséquence d’une sténose, c’est-à-dire l’atténuation du flux coronaire. Il s’agit donc d’un outil d’évaluation fonctionnel intracoronaire qui, à la différence de tests non invasifs tels qu’échographie, scintigraphie ou IRM de stress, permet de ne pas raisonner en termes de territoire sans connaître la lésion responsable de sa souffrance, mais de segment artériel à traiter, avec donc des implications pratiques pour l’angioplasticien.
Il est important de préciser que le capteur de pression se positionne en distalité de l’artère étudiée et permet donc d’évaluer non pas le retentissement d’une lésion unique, mais l’amortissement du flux lié à l’ensemble des lésions s’il en existe plusieurs, tout en prenant en compte la collatéralité éventuelle. Ce dernier point est essentiel, car l’existence d’une telle collatéralité peut assurer une perfusion distale satisfaisante malgré une sténose épicardique paraissant serrée.
Un point essentiel concernant la FFR est son caractère relativement indépendant de certains paramètres hémodynamiques. Ainsi, la FFR est fiable même en cas d’arythmie. À la différence d’autres méthodes d’évaluation fonctionnelle, le retentissement mesuré d’une lésion coronaire reste constant sur plusieurs mesures.
Intérêt de la technique
En l’absence de test d’ischémie localisateur (coronarographie systématique face à une dysfonction ventriculaire, positivité d’un test fonctionnel non localisateur comme un ECG d’effort), l’évaluation visuelle d’une sténose coronaire reste la méthode la plus utilisée pour juger de la nécessité de la « stenter ». Pourtant, dans l’étude FAME, environ 40 % des lésions initialement destinées à la pose d’un stent avaient une FFR rassurante. Certaines publications, comme celle de Sant’Anna et coll. (AJC 2007), ainsi que le registre français multicentrique R3F, redressent le diagnostic chez la moitié des patients.
Il en ressort que seulement 40 % des sténoses estimées visuellement entre 50 et 70 % sont « ischémiantes », et 20 % des lésions classées à l’œil nu entre 70 et 90 % ne le sont pas. Ces chiffres marquants traduisent clairement l’intérêt de la technique.
Sécurité pour le patient d’une approche guidée par la FFR
Si la reproductibilité de la technique et sa fiabilité dans diverses situations anatomiques avaient déjà commencé à être évaluées lors de la décennie précédente, c’est en 2001, avec la publication de l’étude DEFER, que la sécurité d’une approche fonctionnelle invasive a été validée. Trois cent quarante et un patients avec des lésions coronaires pour lesquelles étaient prévues des angioplasties ont été évalués par FFR et classés en trois groupes : FFR < 0,75 (groupe de référence), chez qui l’angioplastie était indiquée dans tous les cas, et deux groupes avec une FFR rassurante ≥ 0,75, chez qui l’angioplastie initialement prévue était réalisée (groupe « perform ») ou bien différée (groupe « defer »). Chez ces patients aux FFR rassurantes, le suivi jusqu’à 5 ans ne met pas en évidence d’excès d’événements dans le groupe différé par rapport au groupe où l’angioplastie a été réalisée et permet de conclure à la sécurité d’une telle approche.
Le groupe de patients aux lésions fonctionnellement significatives (FFR < 0,75) présentait un nombre plus important d’événements que le groupe des FFR rassurantes. Cela était vrai malgré l’angioplastie des lésions aux FFR anormales, ce qui évoque le caractère pronostique d’une coronaropathie fonctionnellement significative.
Comment l’expliquer ? Une lésion avec FFR rassurante, dite « stable », présente un risque de « major adverse cardiac event » (MACE) de l’ordre de 1 % par an. Ce risque est d’environ 5 % en cas de lésion significative. Le risque de MACE lié à la pose d’un stent, indépendamment du caractère bien-fondé ou non, est de 3 %. On comprend donc que la pose d’un stent de manière appropriée diminue le risque de complications, mais que les angioplasties à mauvais escient le majorent.
Validation de la FFR dans différentes situations cliniques
Largement évaluée par de nombreuses équipes de recherche dans le monde, la FFR est principalement promue par les nombreuses publications de l’équipe néerlandaise dirigée par Bernard de Bruyne et Nico Pijls.
L’anatomie coronaire est souvent complexe et variable d’un patient à l’autre. Une technique proposant une évaluation du retentissement fonctionnel se doit d’être valable dans une majorité de situations possibles.
La lésion intermédiaire, l’indication de choix
La FFR a d’abord été démontrée comme un outil de choix dans l’évaluation du classement de lésions angiographiquement intermédiaires (visuellement proches de 50 %) en lésions « ischémiantes » ou « non ischémiantes » avec une excellente concordance avec les trois types de tests d’ischémie que sont l’épreuve d’effort, la scintigraphie au thallium et l’échographie dobutamine.
Il s’agit là de sa principale indication en pratique courante. Les recommandations américaines et européennes de 2010 la classaient respectivement IIaA et IA dans l’évaluation d’une lésion et de la nécessité de la traiter en l’absence de test non invasif.
Les lésions multitronculaires
Plusieurs études ont déterminé l’intérêt de l’usage de la FFR chez les patients pluritronculaires (présentant des lésions sur au moins deux réseaux parmi les trois principaux : IVA, Cx et CD). La FFR permet de corriger le tir dans de nombreuses situations, notamment en précisant le nombre de vaisseaux atteints alors qu’une simple évaluation visuelle l’avait surestimé. Des patients tritronculaires peuvent fréquemment être reclassés bi- voire monotronculaires. Ce courant de pensée a culminé avec l’étude FAME en 2009, qui concluait que, lorsque la revascularisation d’un patient multi - tronculaire était guidée par FFR, le nombre de stents posés était moindre que lorsque la revascularisation se faisait uniquement par évaluation angiographique avec un bénéfice significatif à un an sur le critère primaire combiné de mortalité, infarctus du myocarde et revascularisation.
On notera de manière intéressante qu’il n’existait cependant pas de différence significative en termes de sédation d’angor à un an. D’après le auteurs, cela suggérait que la FFR surestimait la gravité des lésions et que, malgré le nombre de lésions différées, il persistait un taux de faux positifs diluant l’amélioration fonctionnelle du groupe traité par revascularisation, car, rappelons- le, la pose injustifiée d’un stent peut majorer le risque d’un patient.
En effet, la valeur seuil de 0,75 (atténuation significative au-delà de 25 %) utilisée comme référence jusqu’en 2009 avait été revue à la hausse à 0,8 dans FAME (atténuation de 20 % suffisante pour être jugée comme significative) afin de ne pas sous-estimer la gravité de certaines lésions. Cette nouvelle valeur de 0,8 fait malgré tout office de référence aujourd’hui.
Avec un coût de 650 $ par guide de pression, le passage de 2,7 à 1,9 stent posé par patient multi - tronculaire faisait aisément basculer la balance en faveur de la FFR avec une baisse significative du coût de prise en charge des patients, 30 % environ de cette économie étant liée à la diminution des frais de prise en charge lors de la période de suivi (car moins de MACE).
L’atteinte du tronc commun
Les sténoses du tronc commun engagent le pronostic de manière nette et même des études comme COURAGE, qui remettait en question le bénéfice de l’angioplastie dans la survie des patients, excluaient les atteintes du tronc commun. Lorsque ces lésions sont intermédiaires, une décision hâtive de pontage, en cas de flux antérograde sous-estimé, peut avoir des conséquences graves et notamment provoquer l’occlusion du greffon en raison d’un flux compétitif par le réseau natif.
Deux études ont étudié et validé l’intérêt de la FFR dans la classification des sténoses du tronc commun afin de trancher entre traitement médical et pontage (Bech et coll. dans Heart en 2001, avec une valeur seuil à 0,75, et Hamilos et coll. dans Circulation en 2009, avec une valeur seuil à 0,8). Ces études colligeaient d’excellents résultats sur les critères majeurs de survie et de MACE à 3 et 5 ans. On remarquera que, dans ces études, l’évaluation en diamètre de la sténose par l’ordinateur (QCA) était corrélée à la FFR, mais avec une dispersion importante : parmi les troncs communs présentant une sténose évaluée à moins de 50 % (et donc non significative) par QCA, 23 % présentaient une FFR < 0,8, c’est-à-dire justifiant une revascularisation.
Les lésions coronaires en série et l’athérome diffus
Comme nous l’avons précédemment précisé, la FFR n’évalue pas le retentissement d’une unique lésion sur le flux coronaire, mais l’atténuation du flux sur l’ensemble du vaisseau liée à une ou plusieurs sténoses et/ou à l’infiltration athéromateuse diffuse, angiographiquement importante ou non.
Cependant, en cas de lésions en série, par exemple une double sténose sur une artère, l’accumulation de pression en amont du second obstacle peut minimiser le gradient pressionnel de part et d’autre de la première sténose.
Si le capteur de pression du guide devait être positionné entre les deux lésions à évaluer plutôt qu’en distalité du vaisseau dans le but de mesurer leurs retentissements séparés, l’opérateur risquerait de sous-estimer la gravité de la lésion proximale.
Pijls et de Bruyne ont développé une équation complexe permettant d’évaluer le retentissement de chacune des sténoses par mesures étagées, mais cette méthode n’est pas utilisable en pratique, car chronophage et complexe et il convient dans ce cas d’effectuer un retrait progressif du capteur avec une injection d’adénosine, non plus par bolus intracoronaire, mais continue par SAP afin de reconnaître les zones d’atténuation principales du flux.
Lorsque le myocarde d’aval est partiellement ou totalement nécrosé
La régulation du flux n’est pas dictée par les vaisseaux épicardiques, mais par le nombre et le degré de vasodilatation des artérioles du secteur microvasculaire selon les besoins régionaux. En cas de tissu nécrosé, la masse myocardique perfusée par une artère coronaire est amputée ainsi que l’étendue du secteur microvasculaire. Ainsi, un calibre de vaisseau épicardique insuffisant pour l’irrigation d’une région musculaire viable peut devenir suffisant si seule la moitié des cellules de cette région nécessite encore un apport sanguin.
Plus simplement, une sténose qui aurait été significative si l’ensemble du myocarde d’aval avait été viable peut devenir non significative si une portion du muscle est nécrosée (la FFR sera donc supérieure à 0,8), car les besoins d’apport sanguin diminuent. Prenons garde, la FFR n’a pas été validée pour confirmer la nécrose. Mais les études confirment que la valeur obtenue, tenant compte de la masse nécrosée, permet d’évaluer l’ischémie résiduelle du territoire viable en aval de la sténose et donc la nécessité de revasculariser un segment artériel, même en cas d’antécédent d’infarctus dans le territoire étudié.
Devenir des patients
DEFER rassurait quant à l’absence de devenir néfaste chez les patients différés et FAME validait l’intérêt de guider l’angioplastie par la FFR avec un bénéfice patient significatif, mais faut-il « stenter » une lésion avec retentissement fonctionnel ? L’étude COURAGE en 2007, ne montrant pas de différence entre traitement médical optimal (TMO) et TMO doublé d’angioplastie chez des patients aux lésions angiographiquement significatives, remettait en cause l’intérêt de la revascularisation. FAME 2, publiée en 2012, devait évaluer l’intérêt de comparer ces deux mêmes approches, mais en évaluant le caractère fonctionnel plutôt qu’anatomique des lésions, écartant les faux positifs angiographiques et permettant aux patients avec des lésions sans retentissement fonctionnel de ne pas se voir implanter d’endoprothèse possiblement inutile.
L’étude fut interrompue précocement en janvier 2012, un hazard ratio de 0,13 sur le critère primaire combiné (mortalité, infarctus et revascularisations urgentes) apparaissant précocement après inclusion des 1 220 premiers patients. Ce bénéfice net est dû à un excès majeur de revascularisations urgentes chez les patients différés malgré une FFR < 0,8.
Si on peut déplorer l’absence de différence mise en évidence concernant les deux autres points du critère primaire (à savoir mortalité et infarctus du myocarde), l’arrêt précoce de l’étude était préspécifié par les auteurs et le retentissement clinique est franc.
La courbe d’événements des patients ayant bénéficié d’une revascularisation guidée par FFR rejoignait celle des patients avec FFR ≥ 0,8 et donc non stentés.
Là où le bât blesse…
La FFR se présente donc comme un outil d’une utilité non négligeable pour estimer l’intérêt d’une angioplastie sur une lésion coronaire basée sur le retentissement fonctionnel de cette lésion. Dans la majorité des études mentionnées, les patients étaient inclus sur la table de coronarographie, car atteints de lésions pour lesquelles avait été décidé un traitement percutané sur la base de leur aspect angiographique. Mais qu’en est-il des patients qui bénéficient de FFR dans la vie courante ?
Il existe schématiquement deux grandes différences entre une population « courante » de salle de cathétérisme coronaire et la population de ces études.
La lésion dite « intermédiaire »
On remarque encore une tendance forte à user de la FFR, non pas de manière systématique face à toute lésion estimée angiographiquement comme « à revasculariser », mais plus particulièrement pour l’évaluation de lésions estimées comme douteuses. Le principe ancien de la sténose de plus de 50 % du calibre de référence étant ancré dans les mœurs encore à ce jour, un grand nombre d’opérateurs utilise la FFR pour juger de la sévérité d’une lésion bordant cette limite sacrée et classiquement dans la zone 40-70 % sans nécessairement en user pour l’évaluation fonctionnelle de lésions qui peuvent sembler « clairement » serrées et donc à « dilater ». Cela semble d’autant plus paradoxal que l’on reconnaît qu’un grand nombre d’entre elles étaient sans conséquence hémodynamique significative, notamment dans le groupe des 70-90 %. De nombreuses lésions intermédiaires « échappent » donc à un traitement non nécessaire, mais un sous-groupe de sténoses encore trop important serait stenté ad hoc. On sait en revanche que les sténoses > 90 % angiographiquement sont rarement reclassées par la FFR.
To stent or not to stent, is that really the question ?
La FFR permet de classer une artère dans le bras à revasculariser ou non. Mais pris à l’échelle d’un patient, cela peut modifier l’ensemble de la stratégie initialement prévue.
Le registre R3F collige près de 1 000 patients consécutifs en France bénéficiant d’une mesure par FFR. Il compare des stratégies envisagées par les opérateurs ad hoc, c’est-à-dire d’emblée sur les données morphologiques de la coronarographie et après réalisations des mesures de pressions. Les cardiologues devaient en effet se prononcer, avant mesure de la FFR, sur la stratégie qu’ils auraient choisie sur les données purement visuelles de l’angiographie, à savoir : traitement médical seul, revascularisation percutanée des lésions visualisées ou bien pontage coronarien. Il en ressort que bien que la proportion absolue de patients classés dans les trois bras soit grossièrement inchangée par la FFR, la stratégie individuelle par patient est foncièrement différente, car 47 % d’entre eux changeaient de bras.
Au-delà de la décision de poser un stent, la FFR sert en pratique à envisager la stratégie de revascularisation d’un patient sans que le bénéfice de cette technique ait été évalué en ces termes.
Sous-utilisation
Malgré sa facilité d’utilisation et son large champ d’application, la FFR demeure à ce jour sous-utilisée. Sur plus de 250 000 coronarographies annuelles en France, moins de 1 % des examens font appel à cette technique. L’obstacle principal reste le non-remboursement et on ne peut qu’espérer que celui-ci soit obtenu en 2014.
Les alternatives
L’iFR
Dans un esprit de simplification de l’évaluation fonctionnelle d’une lésion coronaire, certaines équipes ont cherché à s’affranchir de la nécessité d’injecter de l’adénosine une fois le guide de pression positionné en distalité du vaisseau. La résistance microcirculatoire étant variable, une hyperhémie contrôlée s’imposait jusqu’alors pour convertir cette résistance en une constante afin que le rapport de deux pressions devienne un rapport de flux. Sen et coll. ont identifié une période lors de la diastole, indemne des variations de résistance et des perturbations liées aux vibrations induites par le flux coronaire et la contraction myocardique (wave-free period). Lors de cette période, ils décrivent une proportionnalité quasi parfaite entre pression et flux coronaire en l’absence d’intervention pharmacologique. D’après leurs travaux, bien qu’avec une valeur seuil différente de celle de la FFR (0,89 plutôt que 0,8), il existerait une concordance satisfaisante avec la FFR (iFR).
Décriée par d’autres équipes, cette méthode n’a pour le moment été que peu évaluée, mais la présentation récente au congrès TCT 2013 de l’étude ADVISE II semble montrer des résultats encourageants avec, cependant, la nécessité de recourir à l’adénosine lorsque l’iFR se rapproche de la zone grise.
FFR en CT scan
Bien que ce ne soit pas le sujet de cet article, remarquons que des équipes ont récemment cherché à développer une évaluation « FFR » par scanographie en étudiant le flux coronaire, et ce, sans nécessité d’induction pharmacologique. Une étude présentée en octobre 2013 au congrès TCT fait mention de 81 % de lésions détectées par cette méthode contre seulement 64 % en estimation coronarographique, comparées à la FFR « classique ».
En pratique
La FFR permet aujourd’hui une évaluation fonctionnelle per-procédurale de lésions coronaires et de différer de manière sûre la décision d’une angioplastie qui aurait été sinon menée sur des données anatomiques pures.
Cette méthode apporte le bénéfice clinique d’une meilleure sélection des sténoses qui méritent une revascularisation percutanée, protégeant donc un grand nombre de patients qui n’auraient pas tiré de bénéfice de la pose d’une endoprothèse, mais qui en auraient pourtant subi les effets délétères. Et n’omettons pas les bénéfices économiques liés non seulement à la réduction du nombre de stents posés, mais aussi aux coûts évités de la prise en charge des effets indésirables de revascularisations non justifiées.
Il existe cependant un hiatus entre la validation théorique de la méthode, dont le bénéfice émane de son utilisation systématique, et la pratique courante, où les opérateurs en usent principalement pour des décisions ponctuelles. Cette sous-utilisation sélective s’expliquant à la fois par la crainte injustifiée de prolonger la procédure et par le non-remboursement de la technique.
Par ailleurs, son utilisation, au-delà de la « simple » décision d’angioplastie ou non, sert aujourd’hui à guider le type de revascularisation, percutanée ou chirurgicale, sans que les conséquences de cette approche aient été étudiées.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :