Publié le 25 sep 2019Lecture 8 min
Paris Echo-Imaging 2019 : les faits marquants
Erwan DONAL, CHU de Rennes
Deux jours et demi intenses de partage autour des usages de l’imagerie pour une meilleure prise en charge des cardiopathies. Paris Echo-Imaging 2019 fut dense par les thèmes abordés et la fréquentation. Plusieurs thèmes ressortent.
La place toujours plus grande de l’imageur dans la « Heart Team »
Il ne faudrait pas limiter l’imageur à celui qui fait les images, c’est avant tout un clinicien qui étend son champ d’exploration via les techniques d’imagerie. Ceci est devenu fondamental aux côtés des anesthésistes, chirurgiens, cardiologues interventionnels, en particulier dans le domaine des cardiopathies valvulaires afin de préciser les indications à une chirurgie, un traitement percutané ou médical. Un nouveau métier doit se développer dans chaque grande structure cardiologique et chirurgicale. Il sera enseigné à un petit nombre d’internes spécialisés à partir de novembre 2020. Le diagnostic d’une régurgitation mitrale, la compréhension des mécanismes et de ce qui pourrait justifier telle ou telle autre stratégie de traitement impose un imageur spécialisé qui voit le patient en amont, pendant et à l’issue de la réparation valvulaire. Si nous revenons sur les insuffisances mitrales secondaires (secondaires à une cardiomyopathie qu’elle soit ischémique ou non ischémique et dilaté, le plus souvent) ; il y a eu les résultats négatifs de Mitra- FR et les résultats très en faveur du MitraClip dans COAPT. Ces deux études nous ont énormément appris et ont permis de soulever de nouvelles hypothèses et des limites à nos évaluations que l’on peut désormais considérer comme passées :
– considérer la surface de l’orifice régurgitant > 20 mm2 pour définir une régurgitation mitrale secondaire comme sévère, cela a été démontré en termes pronostiques, en termes diagnostiques, il faut aller plus loin, il faut être multiparamétrique et sans doute exiger de la fuite qui, après optimisation du traitement médical, soit plus sévère (≥ 30 mm2 tel que dans COAPT). Il faut donc penser à traiter les fuites mitrales secondaires quand elles sont vraiment très sévères et symptomatiques ;
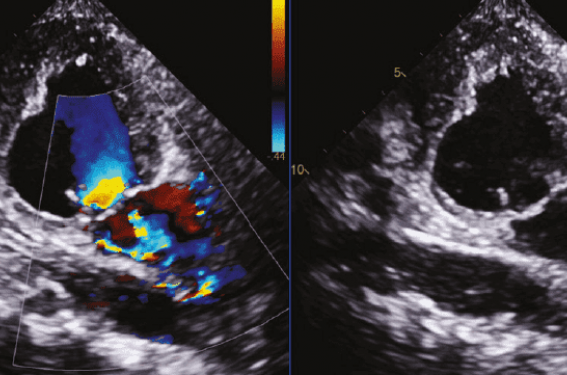
– attention au ventricule gauche : si le ventricule gauche est très défaillant et surtout très dilaté, il est presque normal d’avoir une régurgitation mitrale avec une SOR ± 20 mm². Il faut donc quantifier et analyser précisément la fuite et sa sévérité mais il faut aussi quantifier les dimensions du ventricule gauche et son degré de dysfonction. Probablement qu’en dessous de 20 % de fraction d’éjection, le résultat du traitement de la fuite sera de courte durée, mais plus important : si le ventricule est très dilaté > 70 mm de diamètre télédiastolique, même avec une fraction d’éjection de 35-40 %, il est possible que la fuite mitrale soit « proportionnée » au degré de dilatation et si cela est le cas, le résultat de la correction de la fuite ne sera probablement pas très bon. Si le ventricule gauche a un diamètre de 50 mm avec une fraction d’éjection de 35 %, alors une fuite avec une SOR > 30 mm2 sera un patient avec une fuite dite « disproportionnée, c’est-àdire trop sévère par rapport au degré de dilatation du ventricule : ce type de patient devrait être un très bon répondeur au traitement de la fuite, et ce en particulier par clip mitral (figures 1 et 2). Il faut donc être précis. Aussi, arrivent les prothèses mitrales percutanés qui imposent aussi des analyses spécifiques, de degré de dilatation du ventricule, de l’anneau, de l’oreillette. Il faut analyser les piliers, l’apex du ventricule et l’angle entre le plan de l’anneau et le septum interventriculaire. Il faut regarder la taille et la géométrie de la chambre de chasse du ventricule… autant de choses qui sont fondamentales pour choisir le bon patient, la bonne prothèse pour la bonne procédure qui permettra d’améliorer les symptômes et le pronostic (figure 3). Pour ce faire, l’imageur doit analyser l’échocardiographie 2D, 3D mais aussi le scanner et parfois l’IRM pour quantifier et localiser la fibrose myocardique de remplacement (prise de gadolinium tardive).
Figures 1 et 2. Exemple d’une régurgitation mitrale secondaire proportionnée versus disproportionnée : celle qui sans doute répondra le mieux à la correction de la fuite, en particulier par clip mitral, sera la « disproportionnée ».
Figure 3. Exemple de patient ayant une cardiomyopathie et inaccessible à une chirurgie classique : implantation par voie transapicale d’une prothèse percutanée TENDYNE, Abbott.
• L’intelligence artificielle, ce n’est pas nouveau mais cela prend et prendra toujours plus de place en médecine et en imagerie, dont l’imagerie cardiovasculaire. Les radiologues le savent bien, et la constitution de grandes banques de données parfaitement caractérisées sont des leviers importants pour améliorer le « workflow », faciliter l’usage des logiciels de quantification et de détection automatique des structures, des fonctions et peutêtre de cadres pathologiques… il y a aussi le machine-learning qui n’améliore par l’acquisition mais optimise l’usage des signaux et images qui sont enregistrés par exemple lors d’une échocardiographie. Un examen contient beaucoup de données, le compte rendu actuel comporte beaucoup de mesures que le cardiologue mesure méticuleusement (et c’est fondamental, ce compte rendu avec des données quantitatives précises et leur interprétation cardiologique dans la conclusion !). Cependant, beaucoup de signaux sont non exploités par nos yeux, nos mesures et pourraient pourtant contenir des informations utiles. Les ordinateurs peuvent, par exemple sur une courbe de strain, calculer ≥ 100 paramètres différents et les hiérarchiser pour phénotyper des patients et appréhender précisément ceux qui pourraient être les bons ou les moins bons répondeurs à un traitement, par exemple de l’insuffisance cardiaque. Des résultats très encourageants regroupant des informations cliniques, ECG et échocardiographiques ont récemment été proposés avec mise en évidence de clusters de patients en fonction de leur probabilité de réponse à la resynchronisation (figure 4).
Figure 4. Exemple d’arbre visant à distinguer des phénogroupes différents.
• L’écho d’effort, l’écho de stress : est-ce pertinent à l’heure de l’IRM, de la tomographie par émission de positons et du scanner ? Dans le domaine de la cardiopathie ischémique, les choses bougent avec de nouvelles opportunités pour la FFR en scanner mais aussi pour la meilleure caractérisation de l’ischémie myocardique en médecine nucléaire ou en IRM. L’échocardiographie d’effort reste un examen accessible performant. Il est à la fois sensible et spécifique quand les populations testées sont bien définies (comme pour toutes les techniques, il est important de définir la probabilité pré-test de la positivité du test). L’avantage de l’échocardiographie d’effort tient dans la caractérisation des conséquences de la cardiopathie par exemple sur les valves mitrales ou sur la fonction diastolique et les pressions de remplissage. Aussi, l’échocardiographie d’effort ne jouit pas d’un fort niveau de recommandation pour le diagnostic du rétrécissement valvulaire aortique mais cette pathologie de plus en plus complexe par sa diversité et par la difficulté à attribuer des symptômes à la valvulopathie peut vraiment être mieux appréhendée grâce aux tests dynamiques. L’épreuve d’effort conventionnelle est utile pour les patients asymptomatiques. L’échocardiographie d’effort permet d’aller plus loin et de comprendre d’éventuels symptômes pour un patient pour lequel les données sont au repos équivoques ou pour un patient ayant un rétrécissement valvulaire aortique asymptomatique mais avec une mauvaise tolérance myocardique (montée rapide de la pression pulmonaire, dysfonction ventriculaire gauche, fuite mitrale dynamique et plus rarement de nos jours : valves non compliantes avec bon ventricule (augmentation du gradient moyen > 20 mmHg à l’effort). Il faut donc savoir dans les centres en ayant l’expérience, effectuer une échocardiographie d’effort pour mieux caractériser une valvulopathie ou les données de repos et d’interrogatoire sont insuffisantes pour conclure et définir la meilleure stratégie.
• L’échocardiographie dobutamine (bas débit) et le score calcique au scanner sont des outils très importants quand le rétrécissement valvulaire est supposé serré mais avec un gradient moyen < 40 mmHg. Ces patients, à bas gradient et en particulier lorsque la fraction d’éjection est préservée, posent pas mal de problèmes diagnostiques et thérapeutiques. Ceci est en cours d’évaluation dans une étude multicentrique nationale où le traitement médical est randomisé avec le TAVI ou la chirurgie (figure 5). Il est important de retenir les seuils des « guidelines » internationales même si à l’échelon individuel, en particulier chez la femme, le score calcique ne doit sans doute pas prendre le pas sur l’analyse échocardiographique d’un spécialiste des valvulopathies. Chez l’homme, et si la valve est bien tricuspide, le seuil pour un rétrécissement aortique serré est de 3 000 et chez la femme, on peut penser que le rétrécissement aortique est serré si le score calcique valvulaire est > 1 600.
Figure 5. Analyse de l’aorte en échocardiographie.
• L’aorte est un élément à ne pas oublier lors de tout examen échocardiographique (le 3D peut être très utile quand la dilatation de l’aorte ascendante est asymétrique, en vue parasternale grand axe) (figure 6) et il faut savoir utiliser une imagerie de coupes au moins une fois dans le suivi du patient. L’IRM et le 4D-flow permettent d’aller plus loin dans la compréhension des flux intra-aortiques. L’aorte devra être remplacée au-delà de 55 mm sauf dans la bicuspidie avec facteurs de risque ou la maladie de Marphan où le seuil est de 50 mm de diamètre maximal.
Figure 6. Schéma présentant l’étude ROTAS : testant l’intérêt du traitement du rétrécissement valvulaire aortique à bas gradient et à fraction d’éjection préservée une fois que celui-ci est bien caractérisé en échocardiographie, scanner et même IRM myocardique.
Dans les cardiomyopathies, il est important de connaître la valeur pronostique d’outils échocardiographiques (fonction diastolique, importance de la dilatation, analyse précise de la fonction du coeur droit, strain global longitudinal, etc.) mais aussi, il faut savoir obtenir une IRM spécialisée au moins une fois dans l’histoire d’un patient, qu’il ait une cardiomyopathie dilatée ou hypertrophique. Des informations morphologiques et une appréciation de la qualité du myocarde peuvent être apportées par cette technique (figure 7).
Figure 7. Schéma résumant une proposition de recours aux différentes techniques d’imagerie devant la découverte, au cours du suivi et pour un diagnostic pré-symptomatique d’une cardiomyopathie dilatée selon les recommandations EACVI.
Beaucoup d’autres thèmes ont été abordés au cours de Paris Echo 2019, il ne faudra pas manquer Paris Echo 2021. Il ne faudrait pas non plus manquer toutes les actions pédagogiques de la Filiale d’imagerie cardiovasculaire via www.echowebline. com et les formations e-echo.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :