Rythmologie et rythmo interventionnelle
Publié le 01 jan 2020Lecture 6 min
Quand ablater des extrasystoles ventriculaires ?
Corentin CHAUMONT, Frédéric ANSELME, CHU de Rouen
Les extrasystoles ventriculaires sont très fréquemment rencontrées en pratique clinique, qu’elles soient découvertes de façon fortuite ou à l’origine de symptômes. La découverte d’une hyperexcitabilité ventriculaire doit faire rechercher en premier lieu une cardiopathie sous-jacente qui conditionne le pronostic et le risque de mort subite. Se pose ensuite la question des thérapeutiques à proposer au patient.
Ces dernières années, le perfectionnement des techniques de cartographie 3D et des cathéters d’ablation a permis d’étendre les indications d’ablation. Plusieurs études ont d’ailleurs montré que l’ablation par radiofréquence était supérieure au traitement antiarythmique pour réduire la charge en ESV(1,2) avec un taux de complications relativement faible. Ainsi, l’approche invasive peut dans certains cas être proposée en première intention, et il est essentiel de connaître les différentes indications d’ablation d’ESV.
Une ablation d’ESV doit être envisagée dans trois situations cliniques principales :
– les ESV symptomatiques sur cœur sain ;
– les cardiomyopathies rythmiques induites par les ESV ;
– plus rarement, les ESV malignes initiatrices de fibrillation ventriculaire.
Localisation des ESV
Avant d’envisager toute procédure d’ablation, il est nécessaire de prédire la localisation des ESV à partir d’une analyse détaillée de l’ECG de surface. On peut retenir de façon simplifiée :
– une ESV avec aspect de retard gauche provient du ventricule droit et inversement ;
– une concordance précordiale positive est en faveur d’une origine basale alors qu’une concordance négative suggère une origine apicale ;
– un axe inférieur indique une origine supérieure et inversement.
Des QRS très larges avec un aspect d’empâtement initial sont le témoin d’une conduction ralentie à distance des voies de conduction et peuvent orienter vers une origine épicardique.
ESV sur cœur sain
En l’absence de cardiopathie sous-jacente, les ESV proviennent le plus souvent de la chambre de chasse ventriculaire droite, plus rarement gauche. Elles sont probablement liées à un défaut d’apoptose des cellules non contractiles des chambres de chasse ventriculaires au cours de l’embryogenèse.
Elles sont généralement bien tolérées, mais peuvent entraîner des symptômes à type de palpitations, dyspnée et lipothymies.
En cas de coeur structurellement sain, l’indication d’une procédure d’ablation sera guidée principalement par la symptomatologie du patient ainsi que la localisation des ESV.
Les ESV de la chambre de chasse ventriculaire droite auront typiquement un aspect de retard gauche et un axe inférieur (figure 1).
Figure 1. Aspect typique d’ESV infundibulaires droites (Treguer F, E. Cordiam).
Il est essentiel d’essayer de prédire l’origine droite ou gauche des ESV infundibulaires afin de déterminer le rapport bénéfice/risque d’une procédure d’ablation.
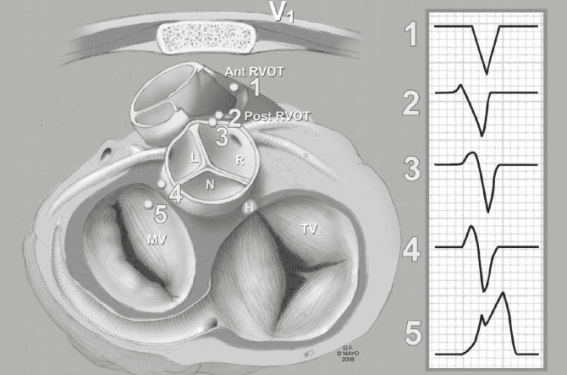
De nombreux algorithmes aidant à la localisation de ces ESV bénignes ont été décrits. Une analyse de la morphologie de l’ESV en V1 permet d’estimer l’origine du foyer même s’il est parfois difficile de prédire sa localisation précise (figure 2). Par ailleurs, une transition précoce dans les dérivations précordiales oriente vers une origine gauche avec généralement un cut-off en V3.
Figure 2. Aspect de l’ESV infundibulaire sur l’électrode V1 en fonction de son site d’origine (Tabatabaei N et al. Circ Arrhythmia Electrophysiol 2009).
• L’ablation est recommandée en première intention (classe I) en cas d’ESV symptomatiques provenant de la chambre de chasse ventriculaire droite. Le taux de succès est alors très élevé avec un faible risque de complications(3,4).
• En cas d’ESV provenant de la voie d’éjection ventriculaire gauche, la procédure d’ablation est plus complexe du fait de la proximité du réseau coronarien et de la nécessité d’un abord transseptal ou rétrograde aortique.
• Les ESV provenant des cusps aortiques représentent 20 % des ESV sur coeur sain, avec une localisation prédominant au niveau de la cusp coronaire gauche. L’ECG retrouve typiquement des ESV larges avec une transition précoce en V1/V2. L’ablation de ces ESV est à risque de lésion du réseau coronarien gauche ; il est parfois nécessaire de réaliser une coronarographie pour évaluer la distance entre le point d’ablation et le réseau coronarien.
Les procédures d’ablation de ces ESV de la voie d’éjection ventriculaire gauche seront donc proposées uniquement dans des centres experts en deuxième intention après échec d’un traitement par bloqueur des canaux sodiques (classe IIa).
Enfin, l’abord épicardique ne devra être envisagé qu’après échec d’une ablation par voie endocardique.
Cardiomyopathie rythmique induite par les ESV
Il est parfois difficile de distinguer une hyperexcitabilité ventriculaire comme étant la cause ou la conséquence d’une cardiopathie à FEVG altérée. Une charge en ESV élevée (> 24 %) et un couplage court (< 300 ms) orientent vers une cardiomyopathie induite par les ESV(3).
La physiopathologie des cardiomyopathies induites par les ESV reste débattue avec probablement un mécanisme lié à l’asynchronisme ventriculaire, mais aussi à la dérégulation du système nerveux autonome.
On peut définir la cardiomyopathie rythmique induite par les ESV comme une altération de la FEVG ou une dilatation ventriculaire gauche en l’absence de cardiopathie préexistante, associée à une hyperexcitabilité ventriculaire, avec une récupération partielle ou complète de la FEVG après traitement efficace des ESV.
Une charge en ESV importante augmente le risque de cardiomyopathie rythmique bien qu’il soit difficile de définir un seuil avec une bonne valeur prédictive. La plupart des études et les recommandations de l’ESC(3,5) retiennent un seuil autour de 20 %, mais certains cas de cardiomyopathies rythmiques sont décrits avec des charges en ESV plus faibles.
Par ailleurs, de nombreuses études se sont intéressées aux caractéristiques des ESV : les ESV très larges, l’aspect de retard gauche, le polymorphisme des ESV(6) et l’existence d’ESV interpolées(7) sont ainsi à plus haut risque de cardiomyopathie rythmique.
Enfin, certains facteurs tels que l’obésité(8) et l’absence de palpitations ressenties par le patient(9) semblent également favoriser le développement de cardiopathies rythmiques.
En cas de cardiomyopathie rythmique induite par les ESV, l’ablation peut être proposée en première intention(4,10).
ESV et cardiopathie sous-jacente
La présence d’ESV fréquentes et de salves de TVNS est un marqueur de risque de mortalité augmenté.
En cas de resynchronisation, l’existence d’ESV fréquentes entraîne une réduction du taux de stimulation biventriculaire, ce qui constitue un facteur de mauvaise réponse à cette technique.
Une ablation pourra être proposée (classe IIa) en cas de d’ESV fréquentes, malgré un traitement antiarythmique, entraînant une non-réponse à la resynchronisation(4).
ESV initiatrices de FV
Certaines ESV peuvent être à l’origine d’arrêts cardiaques survenant sur coeur structurellement sain ; on parle dans ce cas de FV idiopathique. On distingue deux grands types d’ESV initiatrices de FV :
– les ESV du Purkinje : celles provenant du Purkinje droit sont généralement monomorphes alors que les ESV du Purkinje gauche sont polymorphes avec des QRS plus fins ;
– beaucoup plus rarement, les ESV infundibulaires qui ont la morphologie classique décrite ci-dessus, mais avec un intervalle de couplage plus court.
En cas d’arrêt cardiaque récupéré sur FV idiopathique avec un nombre d’ESV restant conséquent, l’ablation de l’ESV initiatrice est recommandée pour prévenir la récidive et limiter les thérapies après implantation du défibrillateur (classe I).
Les ESV du Purkinje peuvent également survenir en phase précoce d’un infarctus du myocarde (automatismes anormaux ou activités déclenchées des fibres du Purkinje lésées) et être à l’origine d’arythmies ventriculaires récidivantes. En cas d’échec des traitements antiarythmiques, l’ablation de ces ESV à couplage court est recommandée dans un centre expert (classe IIa).
L’ablation sera idéalement réalisée en période d’orage rythmique afin de cartographier les ESV initiatrices. Le réseau de Purkinje sera identifié par la présence d’un potentiel fin (< 10 ms) précédant l’activité ventriculaire en rythme sinusal de < 15 ms.
En pratique
Devant la découverte d’une hyperexcitabilité ventriculaire, il faut en premier lieu rechercher une cardiopathie sous-jacente.
La localisation de l’ESV conditionne la faisabilité et le rapport bénéfice/risque d’une procédure d’ablation. Il est donc essentiel d’essayer de prédire l’origine de l’ESV à l’aide de l’ECG avant d’envisager toute approche invasive.
En cas d’ESV sur coeur sain, l’ablation est recommandée uniquement chez les patients symptomatiques :
– elle pourra être réalisée en première intention en cas d’ESV provenant de l’infundibulum ventriculaire droit ;
– en cas d’ESV provenant de la voie d’éjection ventriculaire gauche ou des cusps aortiques, la procédure est plus risquée du fait de la proximité du réseau coronarien, et ne sera donc proposée qu’après échec du traitement antiarythmique.
Certaines ESV semblent à plus haut risque de développement de cardiomyopathie rythmique même si les mécanismes physiopathologiques sont encore incomplètement connus. En cas de suspicion de cardiomyopathie rythmique, l’ablation peut être proposée en première intention.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :