Publié le 05 juin 2012Lecture 6 min
Où en est le stent actif absorbable ?
B. CHEVALIER, Institut cardio-vasculaire Paris-Sud, Massy

Depuis 25 ans, nous implantons des cages métalliques qui mettent les artères coronaires dans un carcan parce que cela reste, à ce jour, le traitement le plus efficace des sténoses coronaires ischémiantes et/ou instables. Même si les progrès réalisés sont considérables sur la nature des matériaux, la sophistication des structures, la biocompatibilité des revêtements et, bien sûr, la délivrance de limus antiresténose, il reste des limites inhérentes à la permanence du dispositif.
Pourquoi un stent absorbable ?
Certaines limitations sont des facteurs de resténose tardive, comme la perte de la conformabilité ou la persistance du stent alors que la drogue n’est plus présente. D’autres sont des facteurs potentiels de thrombose tardive comme le retard d’endothélialisation, la malapposition primaire ou secondaire ou encore l’élution a minima permanente de paclitaxel avec le stent Taxus. D’autres points peuvent impacter le long terme comme la présence de mailles au site des bifurcations ou les interférences avec le suivi par scanner coronaire qui est maintenant possible avec des doses d’irradiation très faibles.
Mais l’élément le plus intéressant à prévenir est la progression de l’athérome au sein des endoprothèses n’ayant pas resténosé.
L’équipe japonaise de Kimura est la première à avoir décrit ce phénomène qui touchait principalement les artères traitées entre la 5e et la 10e année avec des stents nus. Les modifications rhéologiques induites par la présence des mailles, notamment si elles sont épaisses, par les modifications de conformabilité, notamment aux extrémités du stent, et par la perte de la vasomotricité naturelle jouent un rôle, du moins expérimentalement, dans cette « athéroprogression » intrastent qui se manifeste le plus souvent par la présence de plaques vulnérables ou rompues. Ce phénomène semble exister avec la même fréquence avec les stents actifs ou nus, même s’il pourrait être plus précoce avec les premiers pouvant partiellement expliquer l’échappement tardif a minima observé dans certaines études (figures 1 et 2).
Figure 1. Rupture de plaque intrastent métallique à 61 mois (Nakazawa et al. JACC 2011).
Figure 2. Étude quantitative de coronarographie pour 342 patients à 1, 2, 3 et 4 mois (Serruys et al. Circulation 1988).
Compromis entre fonction temporaire et implantation définitive
La solution est de se débarrasser de la structure d’étayage une fois qu’elle n’est plus nécessaire. On l’oublie parfois mais la resténose en l’absence de stent n’est que partiellement liée à la prolifération intimale qui ne joue que pour un tiers dans la perte tardive. L’essentiel vient du recul élastique précoce et du remodelage chronique qui se stabilise après le 4e mois.
Le stent classique combat ces deux phénomènes mais induit une prolifération limitée par la drogue des stents actifs. Ainsi, il faut qu’un stent absorbable étaye l’artère pendant au moins 4 mois. Cela définit le temps d’absorption qui doit être 3 à 4 fois plus long car la structure perd sa force d’étayage bien avant de perdre de la masse. Le temps d’absorption souhaitable semble donc se situer entre 18 et 24 mois.
Le stent « plastique »
Le dispositif le plus avancé est actuellement le BVS (S pour scaffold-échaffaudage littéralement en français – et non pour stent) développé par Abbott Vascular. Il est constitué d’un corps de maille (à la place du métal habituel) constitué d’acide polylactique en configuration L avec une haute cristallinité qui lui confère une absorption lente (environ 24 mois sur modèle animal). Sur cette maille plastique est placé un coating qui est un mélange d’évérolimus (comme le stent actif classique Xience®) et d’acide polylactique en configuration L et D avec une faible cristallinité (amorphe). Ces deux points lui confèrent une absorption plus rapide et donc une diffusion de drogue proche de celle des stents actifs classiques.
La première version dite « A » a été testée sur une série de 30 patients porteurs de lésions simples avec un seul événement clinique (IDM non Q) après 5 ans de recul sans phénomène de thrombose. Cette première évaluation a conduit à modifier le dessin du stent pour augmenter la force radiale (devenue identique à celle d’un stent métallique) et à modifier le processus de fabrication pour allonger légèrement le temps d’absorption. C’est cette version qui a fait l’objet de l’essentiel des études cliniques.
Les résultats cliniques du « BVS »
Une première étude, dite cohorte « B », nous apprend beaucoup de choses sur le comportement de ce dispositif. En effet, 101 patients, toujours porteurs de lésions relativement simples, ont été suivis, angiographiquement et par échographie endocoronaire et OCT (figures 3 et 4), pour la moitié d’entre eux à 6 et 24 mois et pour l’autre moitié à 12 et 36 mois. On sait ainsi que la perte tardive, au départ légèrement plus élevée à 6 mois que celle d’un stent actif à l’évérolimus (0,19 mm vs 0,11 mm), se stabilise ensuite alors que celle du stent actif augmente (0,27 mm pour le BVS, 0,33 mm pour le Xience à 24 mois). Ceci s’explique par deux phénomènes :
– la récupération de la vasomotricité au site d’implantation, gage de la fonction endothéliale ;
– un remodelage positif artériel concomitant de l’absorption du stent. Parallèlement, les résultats cliniques montrent des taux d’événements type MACE de 6,9 %.
Plus récemment, le registre « EXTEND » a inclus des patients porteurs de lésions plus complexes. Le suivi clinique à 6 mois des 200 premiers patients montre un taux d’événements type MACE de 2,5 %.
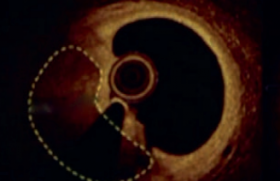
Figure 3. Contrôle par scanner à 5 ans d’un patient porteur de BVS : seuls les marqueurs sont encore visibles.
Figure 4. Malapposition initiale du BVS à 6 mois puis 2 ans (Dr Onuma).
Nous sommes donc en présence de résultats tout à fait comparables à ceux des stents actifs modernes. Il faut noter que le BVS nécessite néanmoins d’être précis dans le choix du diamètre car il ne peut être surdilaté que de 0,5 mm et donc compense moins qu’un stent métallique une erreur grossière d’appréciation.
Bien entendu, il faut maintenant avoir plus de recul sur plus de patients dans des lésions plus complexes. L’étude Absorb II, en cours d’enrôlement, est une étape importante car elle randomise, pour la première fois, les patients entre stent actif moderne ou stent bioabsorbable actif avec un objectif primaire associé de supériorité sur l’angiographie de contrôle à 24 mois.
Quels avantages pour le stent absorbable ?
Les points importants à relever :
– la conformabilité artérielle conservée dès l’implantation du fait de la nature plastique du matériau ;
– la vasomotricité retrouvée au site d’implantation (vasoconstriction sous Méthergin, vasodilatation sous acétylcholine) qui permet à l’artère de répondre aux stimuli physiologiques comme la vasodilatation à l’effort et témoigne d’une récupération au moins partielle de la fonction endothéliale ;
– la disparition des mailles à la 2e année qui supprime les interférences rhéologiques, le stimulus inflammatoire, les limitations d’accès aux branches de bifurcation qui sont des facteurs d’athérogenèse in situ, les malappositions, facteurs possibles de thrombose tardive, les limites d’accès à un futur pontage ou encore les couches multiples de stent dans le traitement des resténoses.
Bien entendu, il reste à traduire cela en impact clinique, ce qui ne peut être le fruit que d’un suivi clinique à long terme, en particulier entre 2 et 5 ans.
Et le stent absorbable métallique ?
Une autre approche a été développée par la société Biotronik, basée sur la résorption d’un alliage de magnésium. Sa première version n’était pas active avec un temps de disparition très court ; il n’est donc pas surprenant que les résultats de la première étude clinique aient partagé les taux de resténose très élevés de l’angioplastie au ballon des années 80. Tirant en partie les leçons de cet échec, l’alliage a été modifié pour obtenir une disparition en 6 à 9 mois et un revêtement au paclitaxel a été ajouté à la surface des mailles. Cependant les résultats font apparaître une perte tardive à 6 mois de 0,68 mm. La perte tardive liée à la prolifération est de 0,33 mm, classique pour le paclitaxel, toujours plus élevée qu’avec les limus. Mais il s’y associe un remodelage négatif chronique de 0,35 mm, certes moins élevé que la version précédente, mais qui témoigne toujours d’un étayage insuffisant dans le temps.
Ceci confirme donc qu’un temps d’absorption long est le gage principal d’une efficacité identique à celle des implants permanents.
Que retenir ?
Le stent bioabsorbable l’est effectivement. Il est jusqu’à présent au moins aussi performant que son parent le plus proche, le stent métallique à libération d’évérolimus.
Ceci est obtenu, entre autres, grâce à un temps d’absorption suffisamment long. Il a des effets favorables sur le devenir de l’artère et a le potentiel de moins stimuler la néoathérogenèse intrastent tardive, toutes choses dont l’impact devrait être retrouvé dans le suivi à long terme.
Nous ne sommes qu’au début d’un programme d’évaluation clinique qui dépasse tout ce qui a pu être réalisé à ce jour pour un implant intracoronaire.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :