Valvulopathies
Publié le 15 mar 2005Lecture 12 min
Cardiopathie dilatée - Le problème de l'insuffisance mitrale
E. MESSAS, hôpital Necker-Enfants Malades, Paris
L’insuffisance mitrale fonctionnelle est définie comme une fuite mitrale sur valve saine dont le mécanisme est lié aux modifications géométriques de l’appareil mitral.
C’est une complication fréquente des myocardiopathies dilatées d’origine ischémique ou primitive. Sa présence, souvent sous-estimée, est source d’aggravation du pronostic à long terme et favorise la survenue de décompensations cardiaques.
La physiopathologie de l’IM fonctionnelle est maintenant mieux comprise grâce aux études expérimentales par échocardiographie tridimensionnelle qui ont souligné le rôle central du remodelage ventriculaire (par déplacement des piliers mitraux) dans la genèse de cette fuite. Son caractère variable et sa sensibilité aux conditions de charge rendent difficiles son évaluation et sa prise en charge.
Les traitements médicamenteux classiques de l’insuffisance cardiaque peuvent diminuer, dans certains cas, l’IM fonctionnelle. La place des techniques invasives (stimulation multisite, plastie percutanée, etc.) et de la chirurgie mitrale restent encore à définir.
Épidémiologie et présentation clinique
La prévalence et l’incidence de l’insuffisance mitrale (IM) fonctionnelle dans les myocardiopathies dilatées d’origine ischémique ou non-ischémique ne sont pas connues avec précision. Le développement, ces dernières années, du Doppler couleur dans la détection des fuites valvulaires a permis d’améliorer l’évaluation de cette régurgitation mitrale qui est le plus souvent sous-estimée par l’auscultation cardiaque. Selon certaines études, la fuite mitrale fonctionnelle est présente chez plus de 57 % des patients avec fraction d’éjection (FE) < 40 %. Sa présence en cas de myocardiopathie dilatée non ischémique multiplie par trois le risque de décès à 3 ans.
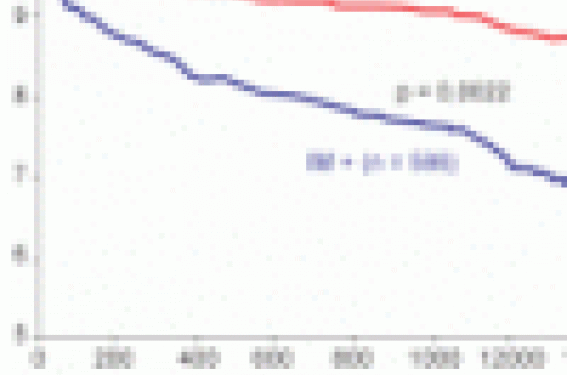
En cas de myocardiopathie ischémique, une analyse d’un sous-groupe de l’étude SAVE (Survival And Ventricular Enlargement) de 727 patients avec FE < 40 % et fuite mitrale modérée à moyenne retrouve une augmentation significative de la mortalité cardio-vasculaire à 4 ans comparativement au groupe sans fuite mitrale et fonction et dilatation VG comparables (figure 1). Dans cette étude, l’IM n’était pas détectée à l’auscultation dans plus de 90 % des cas.
Figure 1. Signification pronostique de l’IM fonctionnelle. Sous-groupe de l’étude SAVE avec fuite mitrale détectée par angiographie dans les 16 jours de l’infarctus. À 4 ans, il existe une augmentation significative de la mortalité cardio-vasculaire dans le groupe avec IM. IM : insuffisance mitrale.
En phase tardive du postinfarctus, une étude plus récente de la Mayo Clinic compare deux groupes de patients avec (n = 194) et sans IM ischémique (n = 109) détectée 16 jours après l’infarctus. La fraction d’éjection est comparable dans les deux groupes (FE = 33 %). Après un suivi de 5 ans, on observe une augmentation significative de la mortalité totale et cardio-vasculaire dans le groupe IM ischémique (61 vs 38 %, p < 0,001 ; 50 vs 30 %, p < 0,001).
Le risque relatif de mortalité cardio-vasculaire double dès la présence d’une IM modérée avec un volume régurgité de 30 ml/cycle et un orifice régurgitant effectif de 20 mm2 et ce, quels que soient le sexe, l’âge, le rythme, la présence d’un diabète, la durée du temps de décélération de l’onde E, la classe NYHA, la FE (même après correction en raison de l’IM) et le degré d’atteinte coronaire.
La présence d’une fuite mitrale fonctionnelle en cas de cardiopathie dilatée ischémique ou non ischémique aggrave le pronostic à long terme de ces patients. La présentation clinique de cette fuite est polymorphe. Elle peut être asymptomatique, responsable d’œdème aigu du poumon (OAP) flash à répétition et, surtout, être variable selon les conditions de charge, rendant son évaluation au repos aléatoire.
Récemment, Pierard et coll. ont étudié par écho-Doppler cardiaque d’effort un groupe de 74 patients avec dysfonction VG (FE = 35 %) et fuite mitrale (volume régurgité de 23 ml). Vingt-huit de ces patients avaient déjà eu un OAP dans leurs antécédents. Le groupe avec OAP présentait une augmentation significative de la fuite mitrale à l’effort (26 ± 14 ml vs 5 ± 1,4 ml, p < 0,001) et du gradient tricuspide antérograde. Cette étude suggère que chez les patients avec dysfonction VG et fuite mitrale, il existe un sous-groupe plus susceptible de faire des OAP par augmentation de l’IM au stress et hypertension artérielle pulmonaire. Ces résultats, s’ils étaient confirmés, seraient en faveur d’une augmentation du traitement par dérivés nitrés et diurétique de l’anse dans ce sous-groupe de patient.
Physiopathologie
Les mécanismes de l’IM fonctionnelle sont complexes et ont récemment bénéficié d’études expérimentales et cliniques réalisées par échocardiographie en 3D.
Ces études ont remis en cause deux dogmes qui ont pendant longtemps été considérés comme les mécanismes uniques de ces fuites :
• la dysfonction de pilier mitral pour l’IM ischémique ;
• la dilatation annulaire pour l’IM en cas de cardiopathie dilatée non ischémique.
Or, ces deux concepts ont été battus en brèche par différentes études expérimentales démontrant :
• dans le cas de l’IM ischémique, que la dysfonction de pilier isolée ne produit jamais d’IM (expérience princeps par Carpentier avec injection sélective d’alcool dans le pilier avec dysfonction secondaire) ;
• dans le cas de l’IM sur cardiopathie dilatée, (expériences in vitro et in vivo de l’équipe de Levine et de Yoganathan) qu’une dilatation isolée de l’anneau mitral ne produit une fuite mitrale qu’au prix d’une dilatation de plus de 75 % de sa surface ; cette expérience a été confirmée chez des patients en fibrillation auriculaire chronique qui, malgré la dilatation auriculaire gauche et annulaire mitrale, ne présentaient pas de fuite mitrale significative (Otsuji 2003).
Les principes de la physique mécanique suggèrent que l’IM fonctionnelle résulte d’un déséquilibre entre les forces agissant sur les feuillets mitraux en systole :
• augmentation des forces de traction avec restriction des mouvements des feuillets mitraux causés par le déplacement des piliers ;
• la dilatation annulaire (remodelage avec sphéricisation ventriculaire) ;
• diminution des forces ventriculaires gauches permettant de fermer la valve mitrale (dysfonction VG) (figure 2).
Figure 2. Physiopathologie de l’IM ischémique. À gauche : coaptation normale avec position normale des piliers. À droite : aspect dit de « fermeture incomplète des feuillets mitraux en systole » (incomplet mitral leaflet closure) secondaire au déséquilibre des forces appliquées sur les feuillets en systole : augmentation des forces de traction (déplacement des piliers mitraux secondaires au remodelage et dilatation annulaire) et diminution des forces de fermeture (dysfonction VG). OG : oreillette gauche. Ao : aorte. VG : ventricule gauche. IM : insuffisance mitrale.
La fuite mitrale aggrave le remodelage VG qui lui-même aggrave la fuite, entrant ainsi dans un cercle vicieux qui aboutit obligatoirement à une aggravation continue de la dilatation VG et de l’IM.
D’un point de vue hémodynamique, l’IM fonctionnelle augmente la contrainte pariétale diastolique puis systolique. Initialement, l’IM joue le rôle de soupape avec éjection d’une partie du débit cardiaque dans un système de basse pression : l’oreillette gauche. Ce phénomène masque pendant longtemps la déchéance myocardique en normalisant artificiellement la fraction d’éjection.
Dans le cas de la fuite mitrale ischémique, le trouble de la cinétique peut être uniquement partiel (le plus souvent inférieur avec déplacement postéro-latéral du pilier postérieur loin de l’anneau mitral), avec un mécanisme IIIb ou mixte (IIIb et I) de la classification de Carpentier (figure 3), la dilatation annulaire peut être absente et sa survenue peut être très précoce. Dans le cas de la fuite mitrale fonctionnelle sur myocardiopathie dilatée non ischémique, la dilatation annulaire est constante, le remodelage VG global déplace les deux piliers avec déformation symétrique de la valve ; la fuite survient le plus souvent tardivement et marque un tournant dans la maladie.
Figure 3. Classification fonctionnelle de Carpentier. Type I : dilatation annulaire. Type II : excès de mouvement des feuillets (prolapsus). Type III : restriction des mouvements des feuillets en diastole (IIIa) et en systole (IIIb).
Échocardiographie
Doppler cardiaque
L’évaluation de l’IM fonctionnelle est difficile car cette fuite est très variable et son intensité varie en fonction des conditions de charges. L’échocardiographie bidimensionnelle (2D) permet de déterminer le mécanisme de la fuite et le Doppler de la quantifier.
En écho 2D vue parasternale grand axe, on retrouve l’aspect typique en aile de mouette ou « seagul sign » du feuillet antérieur témoignant de l’augmentation des forces de traction et traduisant ainsi une diminution de la surface de coaptation (« incomplete mitral leaflet closure »). La surface de tenting est corrélée à l’importance de la fuite mitrale. Cette vue permet aussi d’évaluer la dilatation annulaire (diamètre antéro-postérieur/hauteur du feuillet antérieur > 1,3) (figure 4).
En coupe apicale 4 cavités, on retrouve ce même aspect avec une restriction du mouvement des feuillets mitraux en systole (classe IIIb de la classification fonctionnelle de Carpentier).
Figure 4 A. Vue parasternale grand axe : visualisation de la surface de traction apicale avec angulation du feuillet antérieur (flèche blanche) et fuite mitrale allant sous le feuillet postérieur.
Figure 4 B. Dilatation annulaire mitrale avec évaluation du diamètre antéro-postérieur et de la hauteur du feuillet antérieur.
Doppler pulsé, continu, couleur
La quantification de la fuite mitrale fonctionnelle est rendue complexe par sa grande variabilité et sa sensibilité aux changements des conditions de charge. L’évaluation par la méthode de la PISA (proximal isovelocity surface area), considérée comme indépendante des conditions de charges, donne accès au calcul de la surface effective de l’orifice régurgitant et du volume régurgité. Ces valeurs devront être moyennées tout le long de la systole. Le pronostic semble s’aggraver dès l’apparition d’une IM modérée avec un orifice régurgitant ≥ 20 mm2 et un volume régurgité ≥ 30 ml.
La place de l’échocardiographie de stress dans l’évaluation de l’IM est en cours d’évaluation, mais déjà deux études réalisées par l’équipe de Pierard font date. En cas de cardiopathie ischémique, les IM associées à une cardiopathie ischémique, qui s’aggravent lors de l’épreuve de stress, ont un plus mauvais pronostic à long terme. En cas de dysfonction VG et fuite mitrale, la présence d’une aggravation de cette fuite lors de l’écho de stress favorise la survenue d’OAP et nécessite donc un traitement plus agressif.
Traitement
Traitement médical
Le traitement de l’IM fonctionnelle n’est pas codifié et passe par le biais du traitement conventionnel de l’insuffisance cardiaque. En effet, les inhibiteurs de l’enzyme de conversion et les bêtabloquants devraient, par leur effet antiremodelage favoriser la diminution de cette fuite. D’un point de vue hémodynamique, les dérivés nitrés et les diurétiques réduisent la précharge et la dilatation ventriculaire gauche entraînant une diminution de la dilatation annulaire mitrale et de l’IM. Les vasodilatateurs artériels ou mixtes peuvent aussi diminuer la fuite mitrale en diminuant la postcharge et donc la dilatation ventriculaire gauche et l’impédance artérielle.
Il faut donc, avant d’étudier l’option chirurgicale, s’assurer de l’optimisation du traitement médical de l’insuffisance cardiaque. On insistera sur la prise de bêtabloquants (carvédilol) qui ont démontré dans les études expérimentales et cliniques (Capomella et coll.) leurs capacités à faire régresser le remodelage ventriculaire et la fuite mitrale.
Comme à l’initiation du traitement, en augmentant le temps de la diastole, les bêtabloquants peuvent aggraver transitoirement l’IM et les pressions de remplissages ; il est préférable d’initier ce traitement en milieu hospitalier.
Traitements alternatifs invasifs non chirurgicaux
La fuite mitrale peut persister malgré un traitement bien conduit, souvent limité dans les doses du fait de l’état précaire des patients et des effets secondaires invalidants (hyponatrémie, hypotension orthostatique, bradycardie, etc.). Dans ce cas, on peut se tourner vers plusieurs alternatives :
• en cas de bloc de branche gauche (tronculaire ou distale du fait de la fibrose) avec déphasage inter- et surtout intraventriculaire, certaines études ont démontré la possibilité de la régression de la fuite mitrale après stimulation multisite par resynchronisation des piliers mitraux et par effet antiremodelage. L’échographie Doppler cardiaque peut aider au réglage des délais favorisant la diminution de cette fuite ;
• d’autres alternatives plus récentes et moins codifiées sont en cours d’évaluation. Des études pilotes avec le dispositif ACCORN WRAPP, consistant à envelopper « d’une chaussette » le ventricule afin de limiter la dilatation du VG chez des patients en insuffisance cardiaque terminale, donne aussi des résultats prometteurs sur la réduction de la fuite mitrale fonctionnelle (Raman J. S. et coll. 2001) ;
• d’autres études testent l’efficacité d’une annuloplastie mitrale réalisée par voie interventionnelle utilisant le sinus coronaire comme support (Coapsys device, Cleveland Clinic).
Traitement chirurgical
En l’absence d’études randomisées, cette option thérapeutique n’est prise qu’en dernier ressort. Ses indications sont encore mal codifiées, mais la chirurgie ne doit s’envisager qu’en cas d’IM au minimum moyenne, résistante au traitement conventionnel ou interventionnel et responsable de symptômes invalidants et récurrents. Le timing de l’intervention et la technique utilisée sont encore sujets à discussion.
L’analyse de la littérature retrouve une mortalité opératoire significative allant de 5 à 10 % avec, quand la fuite mitrale régresse, une amélioration significative des symptômes et de la morbi-mortalité et parfois une amélioration à terme de la fraction d’éjection.
Pour la cardiomyopathie ischémique, il est maintenant licite de proposer un geste sur la valve mitrale en cas de fuite mitrale moyenne et indication de pontage coronaire.
En raison de l’hétérogénéité de la présentation des patients avec IM ischémique, il est difficile de comparer l’efficacité de la plastie à celle du remplacement valvulaire. Selon des études récentes, la réalisation d’un remplacement valvulaire est préférée en cas d’équipe chirurgicale opérant peu d’IM ischémique, de mécanisme complexe de l’IM (associant un type I et IIIb de la classification de Carpentier), de comorbidité importante, de trouble de la cinétique segmentaire intéressant la paroi latérale et, enfin, en cas de tenting sévère des feuillets mitraux présageant d’une inefficacité de la réparation mitrale.
Chirurgie valvulaire
Cette chirurgie se fait avec préservation de l’appareil sous-valvulaire (fonction VG) et, selon certains auteurs, avec une bioprothèse impliquant moins de complications chez des patients dont le pronostic à long terme est déjà compromis. La plastie mitrale permet, en cas de succès, une réparation complète avec conservation de la fonction VG.
L’annuloplastie avec un anneau semi-rigide sous-dimensionné constitue la technique de référence. Elle permet de rétablir une coaptation normale entre les deux feuillets en corrigeant plus spécifiquement la dilatation annulaire postérieure. Cette technique est, certes, efficace initialement, mais dans de nombreux cas (entre 20 et 50 %) la fuite mitrale récidive au bout de quelques mois ou années. Ainsi, S. Bolling, l’initiateur de l’annuloplastie sous-dimensionnée souligne que l’IM fonctionnelle est en fait une maladie ventriculaire plutôt que valvulaire. Califiore et coll. ont démontré que l’importance de la fuite résiduelle après annuloplastie est corrélée au degré de traction apicale des feuillets mitraux.
Chirurgies alternatives
L’inefficacité relative de cette technique a motivé l’apparition de chirurgies alternatives ciblant le mécanisme prépondérant de cette fuite : le remodelage ventriculaire avec traction apicale des feuillets (apical tenting). Ces thérapeutiques ont pour but de diminuer l’excès de traction exercée par les cordages sur les feuillets mitraux en systole par :
• repositionnement des piliers vers l’anneau mitral par différentes procédures (plicature de la zone sous-jacente aux piliers, ou transplantation de myoblastes squelettiques autologues à la base du pilier) ;
• section des cordages intermédiaires insérés sur les feuillets mitraux (sur le corps du feuillet antérieur ou postérieur avec ou sans plicature annulaire associée) pour diminuer la restriction de cinétique et augmenter la surface de coaptation mitrale.
Cette dernière approche semble corriger plus directement la malcoaptation mitrale de l’IM ischémique. En effet, en systole, les feuillets mitraux entrent en contact au niveau de la surface de coaptation mitrale (un tiers de la surface des feuillets), permettant une fermeture efficace de la valve mitrale. En cas de remodelage VG ischémique (ou non ischémique), les piliers s’éloignent de l’anneau mitral (déplacement postéro-latéro-apical) et exercent, par l’intermédiaire des cordages, une traction apicale sur les feuillets mitraux prédominant sur le corps du feuillet antérieur. Cela favorise la déformation de ce feuillet qui présente un aspect coudé, responsable d’une diminution de la surface de coaptation (les feuillets mitraux ne se rencontrent plus qu’aux niveaux de leurs extrémités). En sectionnant les deux cordages intermédiaires, on relâche la tension sur le feuillet antérieur qui retrouve une forme normale, améliorant ainsi la coaptation et la fuite mitrale (figure 5).
Figure 5. Efficacité de la section des cordages intermédiaires. A. En haut : mécanisme de l’IM ischémique avec traction apicale des feuillets prédominant sur le centre du feuillet antérieur avec angulation (» bend ») entraînant une malcoaptation et fuite mitrale. En bas : exemple d’une IM ischémique en vue parasternale grand axe avec l’aspect coudé du feuillet antérieur. B. En haut : mécanisme d’action du » chordal cutting » ; après section des cordages intermédiaires disparition de l’angulation et augmentation de la surface de coaptation avec disparition de la fuite. En bas : même patient un mois après chordal cutting et annuloplastie classique, disparition de la fuite mitrale.
Cette technique est déjà appliquée chez des patients par plusieurs équipes chirurgicales qui privilégient une voie transaortique associée à une annuloplastie standard (non sous-dimensionnée). Il semble que les premiers résultats soient assez prometteurs.
Ainsi, la chirurgie mitrale en cas d’IM fonctionnelle reste une opération à risque dont les indications pourraient s’étendre si ses résultats devenaient plus constants.
Conclusion
L’insuffisance mitrale fonctionnelle est une complication fréquente des myocardiopathies dilatées ischémiques ou non-ischémiques. Son mécanisme est multifactoriel et complexe ; elle est principalement secondaire au remodelage ventriculaire et à la dilatation annulaire.
Son évaluation est rendue difficile par son caractère variable et sensible aux conditions de charge. Les traitements médicaux, ayant prouvé leur efficacité sur le remodelage VG (plus particulièrement les bêtabloquants), ont une certaine efficacité sur la régression de cette fuite. L’indication des méthodes invasives (stimulation multisite, coapsys devices, etc.) et de la chirurgie mitrale restent encore à codifier.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :







