Publié le 01 nov 2011Lecture 7 min
Remplacement valvulaire aortique
P. DONZEAU-GOUGE, Hôpital Privé J. Cartier, Massy
Le remplacement valvulaire aortique est actuellement, avec les pontages coronaires, l’intervention la plus fréquemment pratiquée dans les unités de chirurgie cardiaque adulte. Si cette intervention représentait il y a 30 ans 30 % des interventions réalisées, elle représente actuellement près de 40 % de celles-ci, notamment en raison de l’augmentation de l’espérance de vie de la population.
En Europe de l’Ouest, ces remplacements valvulaires aortiques sont essentiellement liés à des atteintes dégénératives (maladie de Mönckeberg) plus qu’à des atteintes rhumatismales ou à l’évolution d’une bicuspidie congénitale ou à des causes plus rares (insuffisance rénale chronique, maladie de Paget, etc.). L’opéré est habituellement un patient de plus de 70 ans, parfois plus jeune en cas de bicuspidie aortique, qui a consulté à la suite de la survenue à l’effort d’une dyspnée et/ou de douleurs thoraciques et/ou de malaises, voire de syncope. L’échocardiographie transthoracique de base, éventuellement à l’effort dans les cas litigieux, va confirmer les données de l’auscultation en montrant le caractère serré du rétrécissement aortique (gradient moyen VG/aorte > 40 mmHg ou vélocité maximale > 4 m/s, surface aortique < 1 cm² ou < 0,6 cm²/m²). Un bilan est alors entrepris, dont une coronarographie qui met en évidence une fois sur trois une atteinte coronaire significative. Au terme de ce bilan, l’indication opératoire est posée et il est alors nécessaire de répondre à deux questions :
– le patient relève-t-il d’un remplacement valvulaire sous circulation extracorporelle (CEC) ou de la mise en place d’une bioprothèse sans CEC par voie transcathéter fémorale ou apicale ventriculaire gauche (TAVI) ?
– quel type de prothèse doit être implanté sous CEC ?
Quel type de prothèse sous CEC ?
La réponse à la seconde question est habituellement univoque, puisque cette atteinte dégénérative intervient chez des patients de plus de 65/70 ans et, dans ce cas, l’espérance de vie d’une bioprothèse est supérieure à celle du patient. Aussi, préfèrera-t-on mettre en place une prothèse biologique qui ne nécessite pas de traitement anticoagulant à vie (figure 1).
Figure 1. Bioprothèse valvulaire aortique péricardique.
Bioprothèse avec ou sans CEC ?
La réponse à la première question (bioprothèse avec ou sans CEC) est donnée par la synthèse du bilan. Si le risque chirurgical de mortalité est > 20 % selon l’Euroscore logistique ou > 10 % selon le STS score, on proposera la mise en place de la bioprothèse par voie transcathéter (TAVI) soit par l’artère fémorale (ou sous-clavière), soit par la pointe du ventricule gauche (ou l’aorte ascendante) abordée par une courte thoracotomie.
On utilisera aussi cette stratégie (TAVI) dans des cas particuliers : aorte ascendante très calcifiée (« porcelaine »), thorax hostile (lésion cutanée radique sévère, déformation thoracique majeure, antécédents de médiastinite ou de pontages coronaires).
Quand on retient une stratégie transcathéter (TAVI), on procède à un bilan complet par angio-scanner de l’aorte depuis l’anneau aortique jusqu’aux artères ilio-fémorales, afin d’apprécier si l’état artériel permet la mise en place de la bioprothèse par voie artérielle fémorale ou sous-clavière. On apprécie ainsi le calibre des artères ilio-fémorales, les calcifications, angulations, sinuosités, l’existence d’un anévrysme, d’un athérome ulcérant ou calcifiant de la crosse... Sinon, on envisage la voie apicale ventriculaire gauche ou celle de l’aorte ascendante en s’assurant de sa faisabilité (absence d’anomalie ventriculaire à type d’anévrysme, de déformation thoracique majeure, d’antécédents de chirurgie thoracique compromettant l’abord de l’apex du ventricule gauche, d’aorte ascendante « porcelaine »...).
Quand on retient une stratégie de remplacement valvulaire aortique sous CEC, le cœur est abordé par une sternotomie médiane. La circulation extracorporelle est réalisée entre une canule veineuse atrio-cave implantée dans l’auricule droit et une canule artérielle implantée au niveau de l’aorte ascendante distale. Les cavités gauches sont déchargées à l’aide d’une canule mise en place au niveau du ventricule gauche par la voie de la veine pulmonaire supérieure droite et de l’oreillette gauche. Après démarrage de la CEC, la ventilation pulmonaire est arrêtée, l’aorte est clampée et le cœur protégé de l’ischémie myocardique par l’injection au niveau de l’aorte ascendante d’un soluté cardioplégique sanguin ou cristalloïde. Ces lésions dégénératives n’entraînent habituellement pas d’insuffisance valvulaire aortique significative justifiant l’injection du soluté cardioplégique par la voie rétrograde du sinus coronaire ou celle antérograde des ostia coronaires. La protection du cœur peut être complétée par la mise en place de glace dans le péricarde en protégeant les nerfs phréniques par des plaques protectrices.
Une fois le cœur arrêté et vidé de son sang, l’aorte ascendante est ouverte au-dessus des deux ostia coronaires par une incision transversale ou plus fréquemment oblique vers le sinus de Valsalva non coronaire, en S italique.
On explore alors la valve aortique qui est plus fréquemment tricuspide que bicuspide, les calcifications sigmoïdiennes, le diamètre de l’anneau aortique et son degré de calcification. On apprécie l’existence d’éventuelles coulées calcaires vers le septum interventriculaire et/ou la face ventriculaire de la valve mitrale antérieure (figure 2).
Figure 2. Valve aortique bicuspide Type 1 L-R.
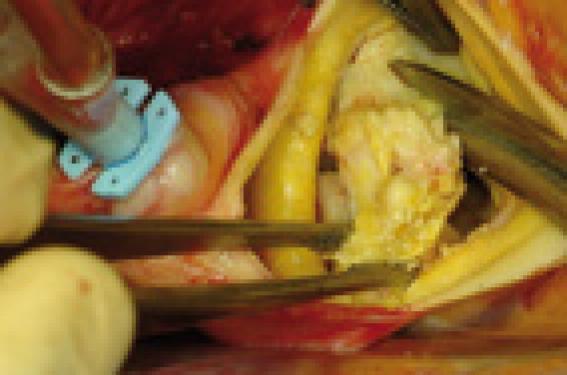
On résèque ensuite les sigmoïdes aortiques immobilisées par les calcifications en poursuivant la décalcification au niveau de l’anneau aortique qui peut alors être fragilisé, de la valve mitrale antérieure, éventuellement du septum interventriculaire et des bourgeons luminaux intra-aortiques (figure 3).
Figure 3. Résection de la valve aortique.
On lave ensuite au sérum la cavité ventriculaire gauche et l’aorte ascendante, afin d’aspirer d’éventuels débris calcaires qui pourraient secondairement emboliser dans les vaisseaux coronaires ou les artères à destinée encéphalique.
Quand l’anneau aortique a été fragilisé, voire rompu par la décalcification, il est reconstruit par des points en U assujettis à des attelles de Téflon® ou par des surjets simples au fil monobrin. On mesure ensuite la taille de l’anneau aortique à l’aide de calibreurs et on apprécie l’encombrement que va créer la bioprothèse à l’aide de testeurs transparents (figures 4 et 5).
Figure 4. Anneau valvulaire aortique.
Figure 5. Mesure de la taille de l’anneau aortique à l’aide d’un calibreur.
On choisit alors le type de bioprothèse que l’on va utiliser (stentée ou micro-stentée le plus souvent, dans certains cas non stentée). On va aussi choisir la taille (diamètre) et le type (intra-annulaire ou supra-annulaire) de la bioprothèse. Ce choix tiendra notamment compte de la surface orificielle effective indexée (EOAI) de la bioprothèse et de la surface corporelle (BSA) de l’opéré(e), de telle sorte que EOAI/BSA > 0,85.
Puis, tandis que la bioprothèse est mise à tremper dans du sérum afin de la laver de la glutaraldéhyde dans laquelle elle a été conservée, on va mettre en place les fils de fixation de la bioprothèse à l’anneau aortique natif décalcifié. Pour ce faire, on passe des points séparés simples ou en « U » de fils tressés assujettis ou non à des attelles de Téflon® que l’on met plutôt du côté ventriculaire de l’anneau aortique (figures 6 et 7).
Figure 6. Passage des points en « U » au niveau de l’anneau aortique natif.
Figure 7. Passage des points en « U » au niveau de l’anneau aortique natif.
Certains préfèrent fixer la bioprothèse par des séries de surjets de fil monobrin. Une fois les fils passés dans la collerette de la bioprothèse (figure 8), celle-ci est descendue au contact de l’anneau aortique et les fils sont noués (figures 8 et 9).
Figure 8. Passage des points dans la collerette de la bioprothèse.
Figure 9. Descente de la bioprothèse.
Après un dernier lavage de la cavité ventriculaire gauche, de la bioprothèse et de l’aorte ascendante, l’aortotomie est refermée habituellement en surjet au fil monobrin en utilisant, selon la fragilité de la paroi aortique, des bandes de feutre de Téflon® (figure 10).
Figure 10. Bioprothèse en place.
Le clamp aortique est alors enlevé, le cœur rempli de sang et purgé de tout air résiduel, tandis que la ventilation artificielle est reprise. Quand le cœur ne défibrille pas spontanément, un choc électrique interne assure sa défibrillation.
Puis, lorsque l’hémodynamique est satisfaisante, on arrête la circulation extracorporelle. Les canules artérielle et veineuse sont enlevées. Du sulfate de protamine est injecté pour neutraliser l’héparine qui avait été administrée avant la mise en place des canules en début d’intervention. Le thorax est refermé après avoir mis en place des électrodes épicardiques temporaires au niveau de l’oreillette et du ventricule droit ainsi que des drains péricardique et rétrosternal.
Après 24 à 48 heures en réanimation au cours desquelles le patient sera sevré de la ventilation artificielle, les drains médiastinaux et les éléments de surveillance seront enlevés (cathéters artériel et veineux, sonde urinaire...), le patient regagnera le secteur d’hospitalisation classique dont il sortira au 7-8e jour postopératoire après l’ablation des électrodes épicardiques temporaires.
La mortalité hospitalière des remplacements valvulaires aortiques selon la base de données EPICARD de la Société française de chirurgie thoracique et cardiovasculaire à propos de 15 310 opérés est de 2,9 % pour les remplacements valvulaires aortiques isolés (11 094 opérés) et de 5,1 % pour les remplacements valvulaires aortiques associés à une revascularisation coronaire (4 168 opérés).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :