Publié le 13 jan 2009Lecture 11 min
Détecter précocement les effets délétères de la chimiothérapie
S. MENASCHÉ, Hôpital Saint-Louis, Antenne de cardiologie
Si la chimiothérapie et, plus généralement, les traitements anti-cancéreux ont fortement amélioré le pronostic de nombreuses affections malignes, la rançon de cette efficacité est le risque de complications cardiaques précoces ou parfois tardives. L’objet de cette mise au point est de passer en revue les différentes méthodes diagnostiques utilisables pour dépister ces effets délétères au plus vite afin de mettre en œuvre les mesures thérapeutiques les plus appropriées dans le cadre d’une collaboration cardio-oncologique.
La cardiotoxicité des traitements anticancéreux (qui débordent le seul cadre des chimiothérapies) est connue de longue date mais elle reste un problème d’actualité pour au moins trois raisons :
– une prévalence en augmentation au fur et à mesure que l’efficacité de ces traitements permet des rémissions prolongées ou des guérisons qui laissent le temps à des manifestations cardiaques tardives d’apparaître ;
– une amélioration des techniques diagnostiques qui doit permettre un dépistage plus précoce,
– la reconnaissance que ce dépistage peut conduire à mettre en œuvre des traitements susceptibles de corriger cette cardiotoxicité ou du moins d’en atténuer les effets délétères.
Données épidémiologiques
La cardiotoxicité du traitement varie en fonction de la nature de la drogue, de sa dose, de la durée du traitement, de la façon de l’administrer, et des associations éventuelles.
Il n’est donc pas possible d’en donner une fréquence globale. Quelques chiffres, toutefois, illustrent l’ampleur du problème.
Ainsi, une diminution asymptomatique de la fraction d’éjection est détectée après administration de doxorubicine à la dose de 240 mg/m2. La toxicité de la drogue est exponentiellement dose-dépendante de sorte que l’incidence de la dysfonction cardiaque induite par les anthracyclines varie de 4 % environ pour une dose cumulative de 500- 550 mg/m2 à plus de 36 % lorsque cette dose atteint ou dépasse 600 mg/m2. Chez les enfants traités pour un cancer, le risque d’insuffisance cardiaque liée aux anthracyclines est estimé à 5,5 % 20 ans après le début du traitement et peut même doubler lorsque les doses ont atteint ou dépassé 300 mg/m2.
À côté des chimiothérapies traditionnelles, les nouveaux médicaments dits biologiques peuvent aussi entraîner des atteintes cardiaques. L’exemple le plus probant est celui du trastuzumab (Herceptine®), anticorps monoclonal dirigé contre le récepteur de la protéine HER2. La multiplicité des protocoles thérapeutiques explique une prévalence variable selon les séries, l’administration simultanée de l’anticorps avec le paclitaxel (Taxol®) après traitement par anthracyclines paraissant particulièrement cardiotoxique. Son association aux anthracyclines et à une chimiothérapie adjuvante basée sur les taxanes entraîne ainsi une dysfonction cardiaque objective chez environ 5 % des patients ; on estime que 2 % développeront une insuffisance cardiaque congestive symptomatique et qu’elle sera sévère (classes III et IV de la NYHA) dans 1 % des cas.
Il est toutefois important de souligner qu’à l’inverse de ce que l’on observe avec les anthracyclines, l’atteinte cardiaque due au trastuzumab est, en général, largement réversible.
À côté des médicaments, la radiothérapie est également une source bien connue de complications cardiaques mais le caractère très évolutif des techniques allant dans le sens d’une sécurité accrue ne permet pas nécessairement d’appliquer aux patients traités aujourd’hui les conclusions tirées d’études antérieures. Il en est ainsi de la péricardite constrictive après irradiation médiastinale pour maladie de Hodgkin ou des atteintes cardiaques (myocardiques, valvulaires ou coronaires) chez les femmes traitées pour un cancer du sein. Classiquement, l’irradiation de l’hémi-thorax gauche, une chimiothérapie associée et le tabac s’associent de façon synergique pour augmenter le risque d’insuffisance cardiaque ou d’infarctus du myocarde mais les techniques actuelles qui irradient moins de 5 % du volume cardiaque conduiront peut-être à revoir ces données.
Il est enfin important de souligner que l’atteinte cardiaque liée aux traitements peut être précoce (contemporaine de ces traitements), plus tardive (dans la première année) ou même franchement différée de plusieurs années (c’est notamment le cas pour la radiothérapie et les anthracyclines).
Ces formes sont souvent graves et constituent le défi majeur à un diagnostic précoce. Cette donnée est particulièrement importante à prendre en compte si l’on considère par exemple que du fait de l’incidence croissante du cancer du sein et des progrès accomplis dans son traitement, il y a actuellement 2 millions de femmes aux États-Unis qui ont une forte probabilité d’être exposées aux anthracyclines et de vivre suffisamment longtemps pour développer ultérieurement une atteinte cardiaque en rapport avec la drogue (le risque étant par ailleurs majoré par la survenue, avec l’âge, des facteurs classiques des événements cardiovasculaires). De même, on estime à plus de 300 000 le nombre de survivants à long terme d’un cancer de l’enfance, toujours aux États-Unis. À 20 ans, la mortalité cardiaque y est 8 fois supérieure à celle qu’on attendrait normalement tandis qu’à 30 ans, le taux d’insuffisance cardiaque chez ces cancéreux « guéris » est 15 fois supérieur à la normale.
Éléments du diagnostic
L’objectif idéal est naturellement d’identifier les patients à haut risque de développer une atteinte cardiaque avant le début du traitement (âges extrêmes, hypertendus, cardiopathie préexistante, chimio- ou radiothérapie préalable) ainsi que ceux qui développent une toxicité asymptomatique pendant ou après ce traitement. Les moyens diagnostiques reposent aujourd’hui sur l’imagerie et les biomarqueurs, en sachant que les incertitudes qui persistent sur la valeur prédictive de ces examens dans le contexte très particulier de l’oncologie justifient une approche combinée.
Imagerie
Les deux examens les plus couramment disponibles sont naturellement l’échocardiographie et l’angiographie isotopique.
L’échocardiographie, malgré son caractère opérateur-dépendent, reste essentielle pour mesurer la fraction d’éjection au repos et éventuellement après un stress pharmacologique. Elle permet surtout une évaluation de la fonction diastolique dont les modifications sont, aussi bien chez l’animal que dans des séries cliniques, beaucoup plus précoces que celles de la fraction d’éjection ventriculaire gauche (FEVG). L’examen de routine doit comporter les mesures en TM des dimensions ventriculaires et de la fraction de raccourcissement (FR), en complétant systématiquement, si l’échogénicité l’y autorise, le calcul de la FEVG par la formule de Teicholtz par un Simpson biplan.
Il n’est pas rare en effet de sous-estimer en TM la fonction systolique de façon non négligeable, chez les patients traités par anthracyclines, en raison d’un trouble cinétique très limité de la portion sous-aortique de la paroi antéroseptale.
Dans la mesure où il s’agit de patients très souvent fébriles, anémiques et/ou soumis à une hyperhydratation, l’utilisation de critères les moins dépendants des variations de charge doit être privilégiée.
La mesure en Doppler du pic E mitral, du rapport E/A et du temps de décélération (TDE) est complétée par l’analyse en Doppler tissulaire à l’anneau mitral du profil de vélocités (Em, Am, Sm) et du temps de relaxation isovolumétrique (TRIV). La mesure du strain et du strain rate a été proposée par Ganame en pédiatrie pour mettre en évidence une atteinte infraclinique : ainsi, dans une population d’enfants traités pour un cancer, survivants en moyenne à 5 ans, l’auteur a mis en évidence des anomalies de fonction diastolique et des critères de Doppler tissulaire chez 15 % d’entre eux alors même que la fonction systolique restait dans les limites de la normale. Dans plusieurs études expérimentales comme chez l’adulte, les données concordent et ont permis d’attirer l’attention sur l’intérêt diagnostique de ces critères et sur les conséquences thérapeutiques potentielles qui en découlent.
Enfin, certains ont proposé l’étude de la réserve contractile mais il faut en connaître les limitations chez des patients tachycardes pendant et souvent à distance de leurs traitements, totalement démusclés et inaptes à soutenir un effort physique.
L’angiographie isotopique est reproductible mais ne peut être répétée aussi fréquemment que l’échocardiographie. Elle n’est pas utilisée en pédiatrie et l’acquisition des images couplées à l’électrocardiogramme rend compte des limites techniques liées à une tachycardie ou à un trouble du rythme. Son intérêt dans ces indications de dépistage précoce est illustré par une série de 1 487 patientes porteuses d’un cancer du sein métastatique et suivies pendant 7 ans par scintigraphie ; 287 d’entre elles ont été identifiées à haut risque sur la base de 3 critères (baisse absolue de 10 % de la fraction d’éjection par rapport à la valeur de base, dose cumulée élevée d’anthracyclines [> 450 mg/m2] et fraction d’éjection initiale < 50 %) ; l’interruption, sur ces arguments, de la doxorubicine a diminué effectivement la probabilité de survenue d’une insuffisance cardiaque. Dans le cadre des techniques scintigraphiques, il faut mentionner l’utilisation d’anticorps radioactifs anti-myosine, apparemment très sensible mais insuffisamment spécifique pour identifier les patients chez lesquels l’arrêt du traitement est indiqué.
Les techniques de mise en évidence d’une ischémie et de recherche de viabilité concernent finalement assez peu de patients, et sont utilisées, soit du fait de facteurs de risque athéromateux et en fonction du contexte clinique, soit en cas de découverte d’anomalies de la cinétique segmentaire, soit dans un contexte de douleurs thoraciques suspectes au cours ou au décours de certains traitements (5-fluorouracile, asparaginase, pentostatine, interférons). En revanche, on peut déjà prévoir que les progrès réalisés dans le domaine des allogreffes de moelle nous conduiront dans les prochaines années à prendre en charge davantage de patients dont le pronostic vital ne sera plus lié à la maladie hématologique mais à une pathologie artérielle athéromateuse sévère.
L’imagerie par résonance magnétique (IRM) a pour intérêt majeur une reproductibilité qui pourrait permettre de réduire le nombre de patients à inclure dans les essais visant à tester la cardiotoxicité des nouvelles drogues mais elle ne peut constituer un examen de surveillance régulière. Wassmuth et coll. ont montré la possibilité de mettre en évidence des modifications précoces de contraste myocardique (rehaussement tardif) sous anthracyclines ; l’IRM pourrait en particulier être utile lorsqu’on ne dispose pas d’une fenêtre échographique correcte.
Le scanner est actuellement surtout utilisé pour l’analyse des pathologies péricardiques ou myocardiques tumorales, mais il ne fournit pas, ou pas encore, en pratique clinique de données fonctionnelles pour la surveillance des patients d’hémato-oncologie.
Biomarqueurs
Des mesures répétées des taux sériques de troponine T et I pourraient avoir une valeur prédictive chez l’adulte, encore en cours d’évaluation. Toutefois, une étude portant sur 703 patients a déjà pu montrer que lorsque la troponine I, mesurée précocement après la fin de la chimiothérapie et 1 mois plus tard, reste basse (< 0,08 ng/ml), la fraction d’éjection échographique est conservée au cours du suivi (limité cependant à 1 an) ; en revanche, la prévalence des événements cardiaques augmente considérablement dans le sous-groupe dont la troponine est élevée précocement (37 %) ; cette augmentation est encore plus forte lorsque ce marqueur est élevé à deux mesures successives (84 % contre 1 % dans le sous-groupe à troponine basse).
Bien que certaines études concernant les peptides natriurétiques (BNP, NT-pro-BNP, ANP) soient critiquables car rétrospectives ou avec un suivi trop limité dans le temps, la littérature récente souligne la même corrélation entre l’élévation précoce et surtout prolongée des peptides et l’existence de critères échographiques de cardiotoxicité par Doppler tissulaire.
L’étude des biomarqueurs fait partie des protocoles prospectifs de prévention de cardiotoxicité par différents traitements médicamenteux. Toutes les équipes ne les utilisent toutefois pas de façon systématique dans leur pratique quotidienne.
Dans la pratique
Il semble raisonnable de conseiller une surveillance par échocardiographie ou scintigraphie, avant tout début de traitement par anthracyclines et à sa terminaison, mais aussi en cours de traitement lorsque des signes cliniques évocateurs d’insuffisance cardiaque souvent intriqués à un contexte septique surviennent, ou lorsqu’il s’agit de patients « à risque ». Il convient de la répéter tous les 3 mois en cas d’administration du trastuzumab (ou plus précocement en cas de symptômes d’insuffisance cardiaque) et de stopper le médicament si la fraction d’éjection chute au-dessous de la limite inférieure de la normale (quitte à le reprendre si la fonction s’améliore).
Raisonner en « bénéfice/risque »
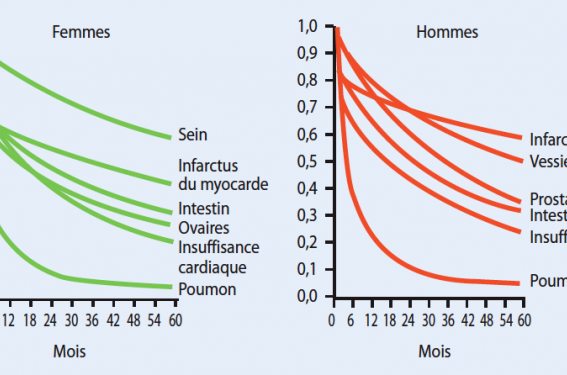
Il est cependant important de noter que l’intérêt de définir des doses cumulatives « sûres », c’est-à-dire minimisant le risque d’une atteinte cardiaque doit être relativisé en fonction du statut cancérologique du patient et l’inconvénient de recommandations trop rigides peut être de priver un malade d’une chimiothérapie salvatrice. C’est ainsi que les études longitudinales de patients traités pour maladie de Hodgkin ou cancer du sein avec un recul de 5 à 20 ans montrent qu’en définitive, le bénéfice oncologique des anthracyclines l’emporte sur le risque de mort d’origine cardiaque. Cette orientation favorable de la balance bénéfice/risque est bien illustrée par la figure ci-dessous.
Figure. Survie comparative à 5 ans de l’insuffisant cardiaque et du cancer.
Conséquences thérapeutiques
Un diagnostic précoce est important car il a de réelles conséquences thérapeutiques sur les modalités du traitement anticancéreux lui-même mais aussi sur les mesures qui peuvent lui être associées.
Les modifications du traitement anticancéreux peuvent prendre diverses formes. Ainsi, dans les cas des anthracyclines, il peut s’agir d’une diminution de la dose cumulée, de l’utilisation d’analogues de la doxorubicine tels que l’épirubicine (moins cardiotoxique) ou de nouveaux systèmes de délivrance de la drogue (doxorubicine liposomale comme le Cardioxane® ou liée à des nanoparticules). De même, les nouvelles formulations du paclitaxel (liaison de la drogue à des nanoparticules d’albumine) peuvent diminuer la toxicité due aux anthracyclines. Enfin, la chronologie d’administration des drogues de même que la durée de leur infusion peuvent aussi moduler leur effets délétères sur le cœur.
Le dexrazoxane
La mise en évidence précoce de l’atteinte cardiaque peut aussi conduire à recourir à des mesures adjuvantes, résultant d’une collaboration accrue entre les oncologues et les cardiologues. Ainsi, le dexrazoxane (Cardioxane®) est aujourd’hui reconnu comme le seul agent susceptible de réduire la cardiotoxicité des anthracyclines, la prévalence d’une cardiomyopathie passant de 23 % dans le groupe placebo à 7 % chez les malades recevant le dexrazoxane après traitement par l’épirubicine et, contrairement à une hypothèse qui a un temps prévalu, il ne semble pas que cet adjuvant diminue l’efficacité anti-tumorale des anthracyclines.
L’énalapril et le carvédilol
On notera que la mise sous énalapril de patients présentant une élévation de la troponine I sur au moins un des prélèvements séquentiels faits après une cure de chimiothérapie se traduit par une absence d’altération de la fraction d’éjection et une moindre prévalence d’épisodes cardiaques que chez les malades non traités.
De même, une prophylaxie par le carvédilol a été montrée, dans un essai randomisé de petite taille, bénéfique sur la cardiotoxicité des anthracyclines.
Bien que les mécanismes de la cardiotoxicité des anthracyclines aient déjà été largement étudiés, des études fondamentales et précliniques restent nécessaires. C’est ainsi que l’interaction entre la voie de signalisation HER-2 (qu’inhibe le trastuzumab) et la régulation de la stabilité du sarcomère est en train d’émerger comme une alternative à l’hypothèse classique du stress oxydant pour expliquer la cardiotoxicité des anthracyclines. Ces données pourraient ouvrir de nouvelles perspectives thérapeutiques si la modulation de cette voie HER-2 se révélait capable d’influer sur la cardiotoxicité des anthracyclines.
Enfin, à plus long terme, il n’est pas douteux que les progrès de la pharmaco-génomique puissent efficacement contribuer à l’identification de polymorphismes susceptibles de prédire au mieux le rapport risque/efficacité de ces différents traitements.
En pratique
Même si on ne peut à proprement parler identifier une spécialité « onco-cardiologique », il existe bien des problèmes spécifiques à la prise en charge, fréquente et en augmentation prévisible, des atteintes cardiaques qui peuvent compliquer les traitements anticancéreux. Un diagnostic précoce doit en être fait sur la combinaison des examens cardiologiques « classiques », que domine l’échocardiographie dont les données semblent pouvoir être utilement complétées par celles des biomarqueurs. Le choix et la chronologie de ces examens sont à adapter à chaque cas sans perdre de vue que le souhait légitime de prévenir ou de traiter une pathologie cardiaque iatrogène ne doit pas conduire à une possible perte de chance sur le plan carcinologique.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :