Publié le 22 avr 2008Lecture 19 min
Insuffisance cardiaque aiguë : des recommandations à la prise en charge
P.-V. ENNEZAT, J.-L. AUFFRAY, J.-J. BAUCHART, J.-M. AUBERT, A. VINCENTELLI et P. ASSEMAN, CHRU de Lille
L’insuffisance cardiaque aiguë (ICA) est un problème de santé publique associé à une morbi-mortalité importante. Il s’agit désormais d’une cause majeure d’hospitalisation parmi les patients âgés de plus de 65 ans associée à des dépenses importantes. Le pronostic est sombre avec une mortalité à 12 mois estimée jusqu’à 40 % en cas d’œdème aigu du poumon. Il s’agit d’une situation critique nécessitant une thérapeutique urgente appropriée à chaque situation physiopathologique.
Une définition clinique
La définition de l’ICA est une première difficulté et explique en partie pourquoi cette situation clinique concerne une population extrêmement hétérogène. Il s’agit d’un syndrome clinique défini par l’apparition récente ou l’aggravation de symptômes ou de signes variés incluant dyspnée, fatigue ou œdème nécessitant une prise en charge rapide en rapport avec une détérioration de la fonction cardiaque qu’il y ait une cardiopathie chronique sous-jacente ou non.
Dans la grande majorité des cas, il s’agit de tableaux d’insuffisance cardiaque (IC) décompensée survenant chez des patients connus pour avoir une dysfonction myocardique systolique et/ou diastolique, qui présentent une exacerbation de leurs symptômes après une période de relative stabilité. L’installation brutale de signes ou symptômes d’ICA chez des patients sans antécédent d’insuffisance cardiaque et une fonction cardiaque normale est beaucoup plus inhabituelle, en particulier en l’absence de syndrome coronaire aigu (SCA) concomitant.
Les causes d’ICA sont diverses (encadré 1) mais parfois mal élucidées. Par ailleurs, les registres récents montrent qu’environ la moitié des patients se présentant avec une IC congestive ont une fraction d’éjection du ventricule gauche normale (> 50 %). Cette population représente en soi un véritable défi pour les cliniciens du fait d’une hypervolémie souvent modeste et de possibilités thérapeutiques très limitées, en particulier sur la dysfonction diastolique sous-jacente.
Le dénominateur pathologique commun à toutes ces étiologies est l’incapacité du myocarde à maintenir un débit cardiaque en adéquation avec la demande énergétique de l’organisme.
On peut distinguer trois groupes de patients déterminés à partir du niveau de pression artérielle systolique mesurée à l’admission, avec des pronostics différents :
• Un groupe hypertendu avec une prédominance féminine et une fraction d’éjection préservée. La mortalité intrahospitalière est la plus faible (2 %) avec 5 % de mortalité et 30 % de réadmission dans les 3 mois.
• Un groupe normotendu caractérisé par une fraction d’éjection plus basse, une mortalité intrahospitalière de 3 %, une mortalité à 3 mois de 7 % et un taux de réadmissions de 30 %.
• Un groupe hypotendu (pression artérielle systolique < 120 mmHg) avec une fraction d’éjection très abaissée, une utilisation accrue d’agents inotropes, une mortalité intrahospitalière de 7 %, de 14 % à 3 mois et un taux de réadmissions de 30 %.
Diagnostic
Le diagnostic clinique et étiologique de l’ICA doit être rapide afin d’administrer un traitement approprié. L’absence de ce dernier accroît naturellement la nécessité d’une ventilation mécanique, la durée de séjour, le coût de la thérapeutique ainsi que la morbi-mortalité. Un diagnostic uniquement fondé sur la clinique risque d’être imprécis car les symptômes et signes cliniques ne sont ni sensibles ni spécifiques et peuvent être partagés avec d’autres étiologies comme l’exacerbation de bronchopneumopathie chronique obstructive. Du fait de l’hétérogénéité du syndrome d’ICA, une large possibilité de signes sont associés à cette condition (encadré 2).
Analyser les signes
• La dyspnée d’effort apparaît comme le signe le plus sensible et la dyspnée paroxystique nocturne comme le plus spécifique.
• Les signes d’élévation de la pression veineuse centrale apparaissent comme le meilleur indicateur pour identifier une ICA mais leur recherche est souvent très imprécise en pratique.
• La pression veineuse centrale peut être néanmoins normale lorsque la fonction ventriculaire droite et la fonction rénale sont normales.
• L’hypertension artérielle systémique observée à l’admission est le plus souvent le résultat d’une vasoconstriction artérielle périphérique liée à l’augmentation du tonus adrénergique, plus que la cause de l’épisode d’ICA.
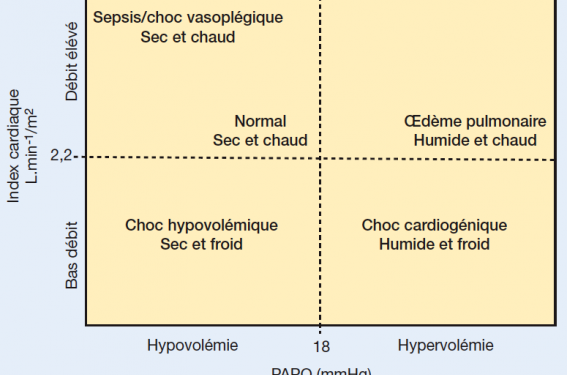
• L’hypotension artérielle doit faire aussi évoquer une hypovolémie aiguë avant de se précipiter sur les vasoconstricteurs (figure 1).
Figure 1. Classification de Forrester modifiée par LW Stevenson.
Éliminer certains diagnostics
Certains diagnostics doivent être évoqués surtout chez les pa-tients jeunes après avoir éliminé un infarctus du myocarde : le phéochromocytome où les pouls peuvent disparaître en cas de vasoconstriction intense, la thyrotoxicose, la myocardite aiguë, le sepsis sévère pendant lequel on peut observer une dysfonction et une dilatation ventriculaire marquée, ou exceptionnellement un béri-béri.
Un certain nombre de tests paracliniques rapidement disponibles au lit du malade permettent d’orienter le diagnostic et la thérapeutique :
• Électrocardiogramme ;
• Radiographie du thorax ;
• Mesure du BNP ou du NT-proBNP ;
• Échocardiographie transthoracique ;
• Analyses biologiques : numération formule sanguine, CRP, créatinine, ionogramme sanguin, glycémie, bilan hépatique, troponine cardiaque, D-dimères, gazométrie artérielle, bilan thyroïdien ;
• Cathétérisme cardiaque droit (en cas de doute diagnostique ou lorsqu’une surveillance rapprochée est nécessaire).
Examens complémentaires
L’électrocardiogramme révèle des signes d’ischémie myocardique, de myopéricardite, d’hypertrophie ventriculaire gauche ou une arythmie rapide, ou peut être normal.
Les signes radiologiques de congestion pulmonaire peuvent être retardés ou discrets en cas d’emphysème pulmonaire associé. De plus, l’amélioration clinique du patient précède souvent la disparition des signes radiologiques.
Le BNP
Une valeur < 100 pg/ml a une valeur prédictive négative de 89 % ; cela signifie qu’un diagnostic uniquement basé sur cette mesure provoquerait un défaut de prise en charge inacceptable dans 11 % des cas. Une valeur normale peut être retrouvée en particulier en cas d’œdème pulmonaire flash, de valvulopathie aiguë ou de sténose mitrale. À l’inverse, une valeur élevée de BNP (mais moins élevée qu’à l’état stable) peut être retrouvée chez les patients insuffisants cardiaques chroniques, mais en situation d’hypovolémie aiguë (pertes gastro-intestinales, traitement diurétique excessif, etc.).
L’échocardiographie trans-thoracique apparaît de plus en plus comme un outil indispensable dans la prise en charge de l’ICA et devrait être utilisée lors de l’épisode aigu. Elle permet de mesurer le débit cardiaque, d’identifier une dysfonction systolique qui peut être transitoire (par exemple dans le cadre de l’ischémie myocardique ou du syndrome de Tako-tsubo), une dysfonction diastolique prédominante, une hypertrophie ventriculaire gauche, une obstruction intraventriculaire gauche, une valvulopathie aiguë ou chronique, une dysfonction de prothèse, une pathologie péricardique, une dysfonction ventriculaire droite avec ou sans hypertension artérielle pulmonaire. Il s’agit également d’un examen clé dans l’identification des complications mécaniques de l’infarctus du myocarde.
Intégrer le résultat à la clinique
Le niveau d’expertise doit être élevé et prendre en compte le tableau clinique pour arriver à un résultat concordant ; une interprétation inadéquate de l’examen échocardiographique peut effectivement influer négativement le pronostic du patient ou conduire à des thoracotomies inutiles ! Une erreur souvent rencontrée en pratique est la constatation d’une veine cave inférieure fine faisant remettre en cause un diagnostic évident d’œdème aigu du poumon, alors que sa taille et son caractère compressible dépendent essentiellement de la fonction ventriculaire droite et de l’atteinte primitive de l’excrétion sodée rénale et non des pressions ventriculaires gauches.
D’autres examens biologiques sont également im-portants. Ils permettent de détecter :
– une hypoxémie importante à l’origine d’une hypoxie tissulaire et d’une acidose lactique ;
– une insuffisance rénale aiguë pouvant nécessiter une épuration extrarénale urgente ;
– une hyperglycémie révélant un diabète ou une intolérance au glucose ;
– un syndrome inflammatoire orientant vers un sepsis ;
– une thyrotoxicose ou une anémie expliquant un tableau d’insuffisance cardiaque à haut débit, une cytolyse majeure, une hyperbilirubinémie et une insuffisance hépatocellulaire qui peuvent parfois révéler la gravité de la condition clinique et contre-indiquer temporairement une assistance circulatoire.
Le cathétérisme cardiaque droit permet de mesurer les pressions intracardiaques droites, la pression capillaire pulmonaire corrélée aux pressions de remplissage ventriculaire gauche et le débit cardiaque. Son utilisation en routine n’a pas montré de bénéfice en termes de morbi-mortalité (essai ESCAPE, JAMA 2005). Il devrait être utilisé essentiellement en cas de doute diagnostique entre un œdème pulmonaire cardiogénique et un œdème pulmonaire lésionnel ou d’absence de réponse à une thérapeutique initiale jugée appropriée.
Les patients jeunes particulièrement graves peuvent également bénéficier de la mesure continue du débit cardiaque et de la saturation veineuse en oxygène afin d’adapter au plus près les thérapeutiques.
Le niveau d’expertise doit être élevé et se rappeler des causes d’erreur : la présence d’une insuffisance tricuspide sévère peut conduire à une sous-estimation ou une surestimation du débit cardiaque, la présence d’un shunt gauche-droit surestime le débit systémique.
La pression mesurée au niveau du capillaire est la pression d’occlusion de l’artère pulmonaire. Elle nécessite toute une série de conditions pour représenter valablement la pression télédiastolique du ventricule gauche pré-A (mesure particulièrement inexacte en cas de sténose mitrale, prothèse mitrale, élévation des pressions intrathoraciques et hyperventilation pulmonaire). De plus, cette pression ne représente pas la précharge du VG qui requiert le volume télédiastolique.
Autres examens paracliniques
La coronarographie est réalisée essentiellement en cas de suspicion d’obstruction coronaire ou pour écarter une obstruction coronaire devant une suspicion de myocardite ou de cardiomyopathie de stress.
Un angioscanner pulmonaire spiralé est réalisé en cas de forte suspicion d’embolie pulmonaire. Ces 2 derniers examens potentiellement délétères pour le rein, tout particulièrement lorsque l’hémodynamique est perturbée, ne doivent être indiqués que s’ils apparaissent nécessaires à la prise en charge diagnostique et thérapeutique de l’ICA.
Le cine valve est un examen important dans le diagnostic de dysfonction de prothèse mécanique.
L’échographie transœsophagienne est indiquée lorsque l’examen transthoracique apparaît insuffisant pour préciser le mécanisme ou pour diagnostiquer une endocardite infectieuse ou une dissection de l’aorte thoracique.
L’écho-Doppler des artères rénales, plus ou moins associée à une angio-IRM ou un angioscanner, est réalisée lorsqu’on évoque des sténoses bilatérales des artères rénales (OAP flash, dégradation rapide de la fonction rénale sous IEC, etc.)
Thérapeutique
Alors que la prise en charge thérapeutique des deux dernières décennies a amélioré le pronostic des patients avec une IC systolique stable, le traitement de l’ICA n’a pas rencontré le même succès.
Les objectifs des traitements pharmacologiques et non pharmacologiques de l’ICA sont multiples et souvent différents en fonction des tableaux cliniques.
Approche pharmacologique
Les diurétiques
La surcharge volémique est fréquente dans la physiopathologie de l’ICA. Le but du traitement est alors de réduire les signes congestifs associés alors à une amélioration rapide des symptômes et une réduction du BNP plasmatique lorsqu’il est monitoré.
Les diurétiques de l’anse sont les plus rapides et les plus efficaces pour obtenir une natriurèse importante. La perfusion continue de furosémide précédée d’un bolus semble avoir plus d’efficacité en comparaison avec l’administration intermittente lorsqu’il existe une filtration glomérulaire réduite ou une résistance aux diurétiques. En effet, l’administration intermittente en bolus est associée à des fluctuations marquées de la volémie intravasculaire (en retour, la baisse brutale de la perfusion glomérulaire est associée à une réabsorption sodée avide) ainsi qu’à des pics sériques de furosémide potentiellement toxiques.
L’association de diurétiques thiazidiques permet d’accroître la natriurèse, la spironolactone peut réduire la perte potassique et l’acétazolamide utilisée prudemment peut corriger une alcalose métabolique excessive.
L’augmentation de la dose de diurétiques a été associée à une aggravation de la mortalité dans des études observationnelles.
Cependant, elle peut être considérée comme un marqueur de gravité de la maladie. Néanmoins, l’utilisation trop « agressive » du traitement diurétique provoque une réduction de la filtration glomérulaire, une activation délétère du système rénine-angiotensine, une déplétion excessive en potassium et en magnésium et une vasoconstriction artérielle périphérique délétère pour la postcharge.
Inversement, on a montré que la disparition des œdèmes des membres inférieurs chez des patients insuffisants cardiaques s’accompagne d’une amélioration de la vasodilatation artérielle périphérique. Nombre de patients admis avec un œdème aigu du poumon présentent effectivement une hypervolémie discrète ou absente, le volume sanguin étant détourné ou stocké dans la circulation pulmonaire du fait d’une augmentation aiguë de la postcharge et/ou d’une hyperperméabilité alvéolo-capillaire nocturne. Les doses de diurétiques doivent être alors réduites et associées à des doses efficaces de vasodilatateurs (voir infra).
Vasodilatateurs
La réduction de la précharge par les veinodilatateurs est efficace dans la prise en charge de l’ICA, notamment associée à une ischémie myocardique, pour réduire la congestion pulmonaire et la demande du myocarde en oxygène sans compromettre le débit cardiaque.
La morphine, bien que n’ayant pas fait l’objet d’étude contrôlée, est un vasodilatateur veineux très efficace mais elle doit être évitée en cas de signes d’épuisement respiratoire.
Les dérivés nitrés à faibles doses sont uniquement vasodilatateurs veineux ; la vasodilatation artérielle systémique et coronaire se produit pour des doses élevées. Ils peuvent être administrés de façon répétée par voie sublinguale (spray ou gélules) avant la pose de la voie veineuse. Des petites études randomisées ont démontré qu’ils sont plus efficaces (réduction de la nécessité de ventilation mécanique) en bolus de 3 mg toutes les 5 minutes qu’en perfusion continue. L’administration de dérivés nitrés doit être interrompue en cas de chute de la pression artérielle systémique au-dessous de 100 mmHg. Un désavantage de cette classe thérapeutique est l’apparition rapide d’une tachyphylaxie nécessitant d’augmenter les doses avec l’apparition fréquente de céphalées.
La réduction de la postcharge réduit également la consommation d’oxygène myocardique et améliore l’éjection systémique. Le nitroprussiate de sodium peut être très utile en cas d’hypertension artérielle systémique sévère ou d’insuffisance mitrale ou aortique aiguë. La posologie doit être titrée progressivement avec un monitorage tensionnel étroit. Son administration prolongée peut se compliquer d’une intoxication au cyanure favorisée par l’insuffisance hépatique ou rénale. Son utilisation au cours des SCA est controversée du fait de la possibilité de vol coronaire.
Le nésiritide, molécule recombinante du BNP humain, réduit la précharge et la postcharge mais n’est pas commercialisée en France. Sa supériorité par rapport aux dérivés nitrés semble modeste.
Après stabilisation de l’insuffisance cardiaque, les vasodilatateurs intraveineux doivent être relayés par un traitement inhibiteur de l’enzyme de conversion à posologie progressivement croissante en surveillant la fonction rénale. L’initiation par captopril peut être un avantage du fait d’une demi-vie courte et d’un bénéfice sur la perfusion rénale (caractère pulsé de la vasodilatation préglomérulaire).
Les agents inotropes (vasodilatateurs)
Le recours aux agents inotropes est indiqué en présence d’une dysfonction systolique du ventricule gauche associée à une hypotension artérielle et des signes d’hypoperfusion tissulaire ; il peut être envisagé en cas d’œdème pulmonaire réfractaire aux diurétiques et vasodilatateurs. Ils augmentent le débit cardiaque, réduisent la postcharge et les résistances vasculaires pulmonaires mais peuvent potentiellement augmenter la demande myocardique en oxygène et provoquer des arythmies délétères (surcharge calcique intracellulaire) pour l’hémodynamique. Leur utilisation doit, par conséquent, être prudente et appropriée et seulement après avoir éliminé une hypovolémie.
La dobutamine est un inotrope vasodilatateur avec une action essentiellement bêta-1-agoniste et faiblement bêta-2-agoniste. Il n’est pas nécessaire d’augmenter les posologies au-delà de 20 mg/kg/min du fait d’un effet chronotrope délétère et parfois de l’apparition d’une vasoconstriction artérielle périphérique. La dopamine est peu utilisée avec un effet rénal théorique en dessous de 2-3 mg/kg/min.
La milrinone et l’énoximone inhibent la phosphodiestérase de type III, augmentant ainsi les taux d’AMPc dans le myocarde et le muscle lisse vasculaire, ce qui accroît la contractilité myocardique et produit une vasodilatation artério-veineuse marquée. Pour cette raison, la milrinone ne peut être utilisée qu’en cas de pression artérielle systémique préservée. Enoximone et milrinone sont théoriquement préférées chez les patients sous bêtabloquants ; cependant, la dobutamine est en pratique efficace chez ces patients.
Ces deux agents peuvent être associés pour augmenter davantage le débit cardiaque. La posologie des agents inotropes doit être titrée avec un monitorage étroit de la pression artérielle et de la fréquence cardiaque.
Le sevrage devrait également être progressif avec de façon concomitante un relais par IEC.
Le captopril apparaît comme un IEC de choix car de demi-vie courte et d’effet favorable sur la perfusion glomérulaire.
Les agents vasopresseurs
En l’absence d’efficacité des agents inotropes et après correction d’une hypovolémie, le recours aux agents vasopresseurs et inotropes est considéré pour restaurer une pression artérielle moyenne et une perfusion périphérique efficace. Ils sont donc réservés aux défaillances circulatoires graves comme le choc cardiogénique. Cependant, ils peuvent aggraver les conditions de charge et altérer la perfusion des organes périphériques en majorant la vasoconstriction artérielle systémique.
La dopamine à forte dose (> 5 mg/kg/min) devient un vasoconstricteur périphérique (de moins en moins utilisé). La norépinéphrine est un agent a-agoniste puissant. L’épinéphrine est une catécholamine ayant des actions a- et b-agonistes puissantes. Leur utilisation apparaît comme un signe de mauvais pronostic et doit faire évoquer l’utilisation de techniques d’assistance circulatoire si l’âge et les fonctions des organes périphériques le permettent. À l’inverse, en cas de vasoplégie périphérique liée à l’inflammation systémique associée à l’insuffisance cardiaque aiguë ou à un sepsis sous-jacent, les agents vasoconstricteurs permettent de corriger une hypotension artérielle systémique délétère pour la perfusion des organes périphériques.
Une adaptation des posologies doit se faire en continu avec un monitorage étroit de la pression artérielle et de la fréquence cardiaque, voire à des mesures hémodynamiques centrales par cathétérisme droit. Les bolus doivent être absolument évités et le sevrage doit être progressif.
Approche non pharmacologique
La reperfusion coronaire par angioplastie en urgence est préférée à la fibrinolyse à la phase aiguë d’un infarctus du myocarde compliqué de choc cardiogénique mais nécessite parfois une ventilation mécanique préalable pour réaliser la procédure dans de bonnes conditions. La reperfusion de la coronaire droite est spécialement indiquée dans les infarctus étendus au ventricule droit, même vus tardivement, du fait du potentiel important de récupération de la fonction ventriculaire droite.
La chirurgie cardiaque est indiquée en urgence pour les dysfonctions de prothèse (désinsertion ou thrombose), les valvulopathies gauches aiguës régurgitantes, notamment en cas d’endocardite infectieuse, et parfois dans la pathologie coronaire non accessible par angioplastie percutanée. La valvuloplastie ou l’implantation de valves par voie percutanée sont réservées à ce jour aux contre-indications temporaires ou définitives à la chirurgie.
L’ultrafiltration
L’ultrafiltration veinoveineuse semble une voie prometteuse pour réduire l’hypervolémie des patients insuffisants cardiaques décompensés. L’essai randomisé UNLOAD incluant 200 patients démontre que l’ultrafiltration est plus efficace que l’administration intraveineuse de diurétiques sur la perte de poids (objectif primaire). Elle diminue l’utilisation des thérapeutiques vasoactives et le taux de ré-admission à 90 jours (objectifs secondaires).
L’assistance respiratoire
L’oxygénation nasale ou par masque à haute concentration est recommandée systématiquement en ciblant une saturation artérielle en oxygène > 90 %. L’assistance respiratoire par CPAP (valve de Boussignac) s’est révélée très efficace et permet d’éviter nombre d’intubations trachéales en cas d’œdème aigu du poumon. Par ailleurs, elle est tout aussi efficace que la ventilation non invasive par BIPAP. Le recours à la ventilation mécanique est essentiellement indiqué lorsqu’il y a des signes cliniques d’épuisement respiratoire.
L’assistance circulatoire
Les techniques d’assistance circulatoire temporaire sont indiquées chez les patients en ICA ne répondant pas aux thérapeutiques conventionnelles, soit dans l’attente d’une récupération myocardique (myocardite fulminante, myocarde hibernant), soit dans l’attente d’une greffe cardiaque.
La contre-pulsion par ballonnet intraaortique, technique la plus répandue, améliore la perfusion coronaire et réduit significativement la postcharge. Son utilisation apparaît surtout efficace en cas d’insuffisance coronaire. Mise en place par cathétérisme fémoral, c’est la thérapeutique invasive utilisée en première intention après un échec du traitement médical.
L’assistance circulatoire devrait être discutée en l’absence de comorbidités.
En l’absence d’amélioration d’un patient en choc cardiogénique bénéficiant d’un traitement optimal chez qui l’on constate :
- une hypotension artérielle systémique avec PAS < 90 mmHg ;
- une diminution de la diurèse horaire ;
- une diminution de l’index cardiaque < 1,8 l/min/m2 ;
- une diminution de la SVO2 (% extraction veineuse de l’O2) ;
- à l’échographie cardiaque, l’absence d’amélioration de la FEVG < 20 % ;
- sur les examens biologiques : hyperbilirubinémie, cytolyse, baisse du facteur V, insuffisance rénale.
À ce stade, le suivi horaire du patient est vital, il est surveillé de façon optimale par une sonde de Swan Ganz.
Les bilans hépatiques et rénaux sont répétés toutes les 6 heures et toute dégradation doit conduire à une décision thérapeutique rapide.
La décision quant à l’indication de la transplantation en urgence ou l’implantation d’une assistance circulatoire est collégiale (cardiologues, chirurgiens et réanimateurs). Cette décision est influencée par un ensemble de paramètres cliniques, échographiques, hémodynamiques et biologiques. Au premier plan, une souffrance viscérale (rénale et/ou hépatique) engage le pronostic vital à très court terme.
La transplantation cardiaque en urgence
On vérifie en premier lieu l’absence de contre-indication à la transplantation (encadré 3). À ce stade, l’insuffisance hépato-cellulaire peut contre-indiquer la transplantation et faire préférer une autre technique. Pour pouvoir bénéficier de la SU (super urgence) le patient doit être, en USIC, dépendant des inotropes et/ou sous ECMO (extra corporeal membrane oxygenation) et/ou ventilé.
La SU permet de placer le patient receveur en priorité nationale : tous les greffons cardiaques compatibles, disponibles, sur le territoire lui seront proposés. Ce statut est limité à 2 fois en 48 h. Au-delà, en l’absence de greffon, il faut s’orienter vers une assistance circulatoire mécanique de longue durée à l’aide de ventricules artificiels.
L’assistance circulatoire par ECMO
Il s’agit d’un dispositif comprenant une pompe centrifuge qui permet de drainer le sang puis d’assurer une perfusion systémique après passage sur une membrane d’oxygénation. Elle permet d’apporter un débit circulatoire qui atteint 6 l/min. L’implantation peut être réalisée au « lit du patient » par cathétérisme des vaisseaux fémoraux.
Cette technique dite « périphérique » est utilisée chez les patients en arrêt circulatoire sous massage cardiaque ou avant un transfert de courte durée d’un centre périphérique vers un centre de chirurgie cardiaque. Mais la technique « centrale » permet d’emblée un drainage optimal avec une perfusion systémique antérograde. Par sternotomie, elle permet de drainer les cavités droite et gauche (oreillette droite et oreillette gauche ou artère pulmonaire) ; la canule artérielle est implantée dans l’aorte.
Cette technique plus invasive permet des assistances de plus longue durée (> 2 semaines) en attente de récupération des fonctions viscérales et semble plus efficace. Les ECMO périphériques sont ainsi généralement converties en ECMO centrales dès que le patient peut atteindre un bloc de chirurgie cardiaque.
L’assistance circulatoire par ventricules artificiels
Il s’agit de la mise en place par sternotomie sous circulation extracorporelle d’un dispositif comportant un ou deux ventricules artificiels. Ainsi, en cas de défaillance isolée du ventricule gauche (défaillance postischémique), on s’orientera vers une assistance monoventriculaire par pompe axiale électrique de type « Heartmate 2 ». S’il s’agit, en revanche, d’une défaillance biventriculaire, il faudra implanter deux ventricules pneumatiques « Thoratec » ou « Jarvik ».
Indications
Chez un patient en choc cardiogénique et malgré un traitement médical optimal, la SU doit être proposée en première intention en l’absence de contre-indication à la transplantation. En cas de souffrance viscérale, une stabilisation par ECMO sera d’abord utilisée. Depuis la création de la SU et l’utilisation de l’ECMO, l’assistance circulatoire mécanique ne semble plus se positionner en première intention. Ces techniques pourront être proposées en l’absence de greffon ou de façon définitive (en cas de contre-indication à la transplantation) après une stabilisation par ECMO.
En revanche, chez un patient sous ECMO, en l’absence d’amélioration des perturbations viscérales (majoration d’une hyperbilirubinémie, d’une cytolyse) ni la transplantation, ni l’assistance circulatoire mécanique ne seront proposées.
En conclusion
L’insuffisance cardiaque aiguë est un syndrome peu spécifique (dyspnée, signes d’hypoperfusion périphérique) extrêmement hétérogène, nécessitant une compréhension physiopathologique rapide au lit du malade pour offrir au patient une thérapeutique urgente spécifique et adaptée. L’examen clinique doit être performant avec une appréciation indispensable de l’âge physiologique et de l’état psychologique. Une valeur de BNP ne doit pas être interprétée isolément. L’écho-Doppler cardiaque apparaît comme un examen clé mais extrêmement dépendant de l’expérience de l’examinateur et de son interface clinique.
L’utilisation des inotropes est inéluctablement délétère à moyen terme comme dans le cas de l’insuffisance cardiaque congestive chronique, voire à court terme comme en cas de valvulopathie aiguë où la stabilisation n’est que temporaire et en quelque sorte « trompe-l’œil ». Ils sont malgré tout souvent incontournables en situation aiguë et sauvent des vies (malgré l’absence d’essai clinique).
La reconnaissance des malades chirurgicaux doit être rapide. Une confrontation médico-chirurgicale doit être rapidement organisée pour les malades critiques et jeunes. Le médecin ne doit pas retarder une prise en charge chirurgicale (thrombose de valve, endocardite, myocardite fulminante, valvulopathies sévères) sous peine de voir apparaître des signes de souffrance viscérale contre-indiquant alors la chirurgie cardiaque. Même éloigné, tout patient éligible en situation critique devrait bénéficier d’un transfert précoce, voire sécurisé par la pose d’une ECMO, avant transfert vers un centre disposant de l’assistance et de la greffe cardiaque.
Enfin, le grand défi de cette pathologie est son épidémiologie (patients âgés, comorbidités fréquentes) qui nous indique les limites de notre prise en charge.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :