Polémique
Publié le 01 déc 2021Lecture 8 min
Radiothérapie des arythmies ventriculaires
Pierre MAURY et coll.*, Toulouse
Le résultat de l’ablation percutanée des arythmies ventriculaires reste loin d’être optimal, avec des taux de récidives à long terme entre 30 et 75 % en fonction des étiologies et de la durée du suivi. Des substrats difficiles ou parfois impossibles à atteindre par cathéter et/ou des lésions non transmurales et/ou insuffisamment larges ou stables dans le temps malgré les améliorations technologiques de ces dernières années (irrigation, contact, haute puissance, etc.), expliquent ces résultats incomplets.
À la fin des années 1990, la possibilité de détruire expérimentalement une zone ciblée du myocarde par délivrance d’ultrasons à distance (donc de manière non invasive) a pu être démontrée. De la même manière, il a plus récemment été imaginé puis testé l’hypothèse qu’une radiothérapie externe stéréotaxique ciblée pourrait parvenir à la destruction d’une zone précise du myocarde. Ainsi est née la « radioablation ».
Histoire et technique
La radiothérapie stéréotaxique consiste à délivrer de très fortes doses d’irradiation en peu de fractions (1 à 10), au sein d’un volume lésionnel généralement petit et bien circonscrit, après avoir défini très précisément la cible et sous réserve d’une immobilisation stricte du patient. Ceci aboutit à des mécanismes radiobiologiques différents de ceux impliqués dans les irradiations dites conventionnelles, grâce à des doses biologiques effectives bien plus élevées, ce qui explique le terme d’irradiation « ablative ». Cette modalité d’irradiation repose sur une multiplication des portes d’entrée du faisceau, permettant une conformation quasi parfaite entre la dose à délivrer et le volume à traiter, et une très forte chute de la dose dès que l’on s’éloigne de la lésion (très fort gradient de dose).
Cette technique a été décrite dès les années 1950 à la suite des travaux de Lars Leksell, neurochirurgien au Karolinska Institute, initialement pour le traitement non invasif de lésions cérébrales, malignes ou non, en alternative à la chirurgie, par la délivrance d’une très forte dose d’irradiation dans un petit volume lésionnel, après fixation d’un cadre stéréotaxique. Par cette approche « quasi » chirurgicale et l’environnement neurochirurgical de son développement, cette technique a été baptisée « radiochirurgie », ce qui a parfois introduit une certaine confusion dans la nature même de ce traitement.
Par la suite, le développement des accélérateurs linéaires de particules, les progrès de l’imagerie, les systèmes de contention et de repositionnement du patient grâce à une imagerie embarquée au moment de l’irradiation, les modalités de prise en compte des cibles mobiles (comme les lésions pulmonaires), ont permis de s’affranchir du cadre stéréotaxique et une application sur des lésions extracrâniennes. On distingue ainsi désormais la radiothérapie stéréotaxique intracrânienne et extracrânienne : stereotactic body radiotherapy (SBRT) ou stereotactic ablative radiotherapy (SABR). L’acronyme fréquemment utilisé dans le cadre des irradiations stéréotaxiques des arythmies est STAR pour stereotactic arrythmia radiotherapy. Une cible mobile et la proximité des structures cardiaques en sont les principaux défis.
Effets de la radiothérapie stéréotaxique
L’effet biologique et tissulaire est encore mal connu au niveau myocardique, mais pourrait faire intervenir une atteinte retardée de la microcirculation menant à des plages de nécrose ischémique, ou l’apparition de cicatrices liées à une apoptose après cassure de l’ADN et production de radicaux libres, quoique récemment ceci ait été remis en question et qu’une reprogrammation cellulaire des cardiomyocytes soit plutôt impliquée, permettant une amélioration paradoxale de la conduction électrique au sein de la cicatrice empêchant les phénomènes de réentrée.
En pratique
La radioablation stéréotaxique des arythmies va utiliser des accélérateurs linéaires (LINAC) capables de délivrer la radiothérapie stéréotaxique : soit des LINAC classiques équipés pour la stéréotaxie (exemple, Novalis TrueBeam STX™, Varian), soit des LINAC robotisés uniquement dédiés à la stéréotaxie (Cyberknife ™, Accuray). Les caractéristiques de ces machines diffèrent, mais les résultats techniques et probablement cliniques entre les deux types d’équipement sont similaires.
La définition de la cible
La première difficulté repose sur la définition de la cible, réalisée quelques jours avant la séance d’irradiation. Celle-ci doit être envisagée en commun accord entre rythmologues et radiothérapeutes, et idéalement non dessinée de manière empirique et subjective sur le scanner de recentrage.
Une imagerie par scanner (pour les cardiopathie ischémiques) ou IRM (pour les cardiopathies non ischémiques) couplée aux cartes 3D des ablations précédentes (quand elles ont été réalisées) permet de définir au mieux les caractéristiques du substrat ou des circuits (isthmes, cicatrices, zones de sortie des TV, zones de potentiels retardés, etc.). Le scanner permet notamment, en fonction des variations d’épaisseur pariétale, de localiser les isthmes des circuits de TV (logiciel MUSIC, InHeart™). Pour les cardiomyopathies non ischémiques, les cicatrices ou les zones graisseuses intramyocardiques à l’IRM peuvent servir de cibles. Une collaboration étroite entre rythmologues et radiothérapeutes est indispensable au bon déroulement et à l’efficacité optimale de la séance.
Grâce à ces imageries, la cible peut être dessinée plus précisément de manière à englober ces circuits et substrats, puis transmise aux radiothérapeutes dans un format adapté et lisible afin de l’intégrer dans le logiciel de planification de traitement des radiothérapeutes. La cible ainsi définie (GTV pour gross tumor volume) va être ainsi augmentée afin de tenir compte, d’une part, des mouvements internes cardiorespiratoires et, d’autre part, des incertitudes de repositionnement sous la machine de traitement le jour de l’irradiation : le résultat final est le PTV (planning target volume), dont le volume peut varier entre 25 et 100 cc selon les séries, en fonction de la taille de la cible réelle et de la précision des techniques d’irradiation utilisées.
Une fois ce volume défini sur le scanner de planification, les physiciens médicaux, en collaboration avec les radiothérapeutes, vont modéliser en amont la dosimétrie prévisionnelle, afin de tenter de délivrer la dose d’irradiation (généralement 25 Gy) sur le PTV ainsi défini, avec la meilleure conformation possible, tout en épargnant au maximum les organes à risque à proximité de la cible (coeur sain, valves, artères coronaires, oesophage, poumons, nerfs phréniques, tractus digestif).
La gestion des mouvements respiratoire et cardiaque
C’est l’autre difficulté. Les IRM en temps réel sur coeur sain montrent que l’amplitude des mouvements respiratoires atteint 1 centimètre sur l’axe supéro-inférieur (seulement quelques millimètres dans les autres directions) et que celle liée à la contraction cardiaque est inférieure à 4 mm (et encore plus faible en cas de cardiopathie et zones cicatricielles et vraisemblablement noyée dans le mouvement respiratoire). Différentes approches de gestion du mouvement respiratoire peuvent être distinguées :
• les techniques de reconstruction à partir d’un scanner de simulation en 4D, permettant d’obtenir le volume d’enveloppe de déplacement de la cible au cours du cycle cardiorespiratoire : ceci permet d’obtenir une ITV (Internal Target Volume) à partir duquel sera défini le PTV ;
• les techniques d’asservissement respiratoire, soit par gating respiratoire (déclenchement du faisceau d’irradiation durant une phase précise du cycle respiratoire, technique utilisée par le TrueBeam™), soit par tracking respiratoire (le faisceau d’irradiation suit en temps réel le mouvement respiratoire et adapte en continu la forme du collimateur du faisceau (technique utilisée par le Cyberknife™). Dans le cas d’un asservissement respiratoire, on utilise un « marqueur fiduciel » (généralement la sonde de DAI intracardiaque) afin d’assurer le suivi radiologique en continu de la cible et permettre la réalisation du gating ou du tracking durant la séance.
Le jour de la séance, le patient est positionné sous la machine de traitement en s’assurant du repositionnement exact en comparaison avec la position lors du scanner de planification. Selon la méthode utilisée de gestion du mouvement respiratoire, l’irradiation dure entre 10 et 60 minutes environ. L’irradiation est totalement indolore, les patients peuvent être admis en ambulatoire, un cardiologue est présent sur place, surtout pour désactiver et réactiver le défibrillateur. Des irradiations de patients intubés-ventilés voire sous assistance mécanique ont été rapportés.
Les résultats
La première courte série de patients date de 2017, conduisant à une diminution nette du nombre de récidives de TV dans les semaines suivant la délivrance de 25 Gy sur un volume cible de 50 cc (passant de plus de 6 000 épisodes à 4 en moyenne). Les auteurs ont ensuite démarré une étude de phase 2, incluant cette fois 19 cas de TV souvent réfractaire à l’ablation percutanée, avec délivrance de 25 Gy sur un volume cible de 100 cc et une bonne efficacité puisque 94 % de patients ont eu une diminution au moins de moitié des épisodes, même s’il y a eu des échecs (ENCORE-VT). Les effets antiarythmiques sont en règle retardés de quelques semaines, quoique des effets plus rapides aient été observés dans des orages rythmiques.
Effets indésirables
Des effets secondaires ont été relevés, avec des pneumopathies et des péricardites radiques le plus souvent rapidement transitoires. Plus récemment, un cas de fistule péricardo-gastrique a été rapporté. D’autres courtes séries ont été publiées, parfois plus décevantes sur le long terme, mais le plus souvent avec très nette diminution du nombre de récidives, même si des orages rythmiques ont pu récidiver chez quelques patients.
Les risques potentiels de toute irradiation thoracique associent les lésions valvulaires, l’athéromatose coronarienne préprématurée, les péricardites radiques, plus rarement des troubles de la fonction diastolique ou des lésions intra-myocardiques, mais aussi les atteintes nerveuses phréniques, pulmonaires, oesophagiennes et digestives. Historiquement, la mortalité (essentiellement d’ordre cardiovasculaire) après irradiation externe a été décrite comme proportionnelle au volume cardiaque recevant des doses de plus de 40 Gy. Dans la série princeps d’ENCORE-VT, les structures cardiaques recevant le maximum d’irradiation étaient surtout les artères coronaires et le ventricule gauche (environ 10 Gy). Chose intéressante, le défibrillateur implantable (souvent présent chez ces patients) ne semble pas souffrir de cette irradiation, car situé loin de la cible (dose environ 0,1 Gy pour une dose maximale acceptable de 1 Gy).
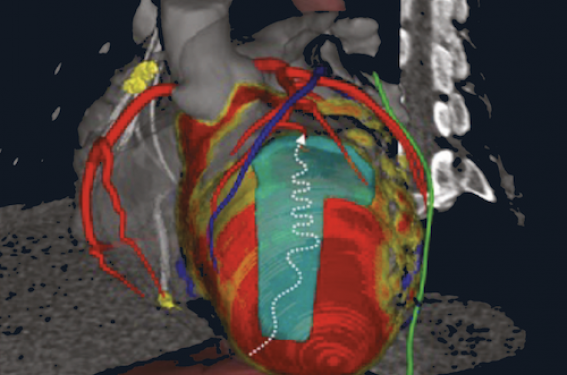
Figure. Cible de stéréotaxie sur séquelle d’infarctus antérieur avec circuit apical.
À gauche : circuit de la tachycardie ventriculaire sur carte d’activation 3D.
À droite : cible dessinée sur le scanner reconstruit avec le logiciel MUSIC et englobant le circuit.
*A. ROLLIN, T. BRUN, J. KHALIFA, A. MODESTO, C. MASSABEAU, Toulouse
H. COCHET, Bordeaux
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :


